
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.四种元素的原子半径:rZ>rX>rY>rW
B.X、Y、Z、W形成的单质最多有6种
C.四种元素均可与氢元素形成18电子分子
D.四种元素中,Z的最高价氧化物对应水化物酸性最强
解析 在周期表中X与Y、Z、W相邻,X、Y的原子序数之和等于Z的原子序数,所以X和Z属于同一主族且Z在X的下一周期,原子序数不大于18,设X的原子序数是a,则a+a+1=a+8,得a=7,或a-1+a=a+8,得a=9。若a=7,则X是N,Y是O,Z是P,又X、Y、Z、W四种短周期元素原子的最外层电子数之和为20,所以W是C,符合题意。若a=9,则X是F,Y是O,Z是Cl,三种元素原子的最外层电子数之和不为20,不合题意。原子半径大小顺序为P>C>N>O,A项错误;C元素可以形成多种单质, B项错误;四种元素与氢可形成PH3、N2H4、H2O2、C2H618电子分子,C项正确;HNO3的酸性强于H3PO4,D项错误。
答案 C


科目:高中化学 来源: 题型:
向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
|
| A. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
|
| B. | 卤化氢的键长按H﹣F、H﹣C1、H﹣Br、H﹣I的顺序依次减小 |
|
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
|
| D. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3+5O2 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(1)a mol NO完全转化为HNO3理论上需要氧气 mol.
(2)为使NH3恰好完全氧化为NO,氨﹣空气混合气体中氨的体积分数(用小数表示)为 (保留2位小数).
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的总转化率.
(4)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.

查看答案和解析>>
科目:高中化学 来源: 题型:
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是( )
A.M元素存在同素异形体
B.M元素为非金属元素
C.M的最高价氧化物对应的水化物都是强酸
D.常温下,能稳定存在的M的氧化物都是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | |
| A | 稀硫酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) |
|
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
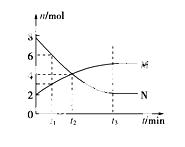 在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
A.反应的化学方程式为2M N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)
 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
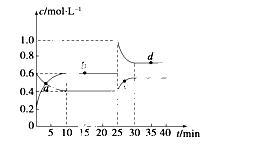
(1)该温度下,该反应的平衡常数为______________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com