
【题目】某无色溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl- B. Fe3+、H+、I-、HCO3-
C. K+、Na+、NO3-、MnO4- D. NH4+、Al3+、SO42-、Cl-
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式____________。
②由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_____________。
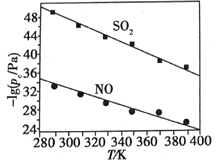
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如图所示。
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为________________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________。
②已知下列反应:
SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) =SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作合理的是
A.用10mL量筒量取7.50mL稀盐酸
B.用25mL碱式滴定管量取14.80mLNaOH溶液
C.用广泛pH试纸测得某碱溶液的pH为12.7
D.用托盘天平称取25.20gNaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B的转化率___________,v(正)__________。
(2)使用催化剂,A的物质的量___________。
(3)增大压强,v(逆)___________,C的产率___________。
(4)增大A的浓度,则B的转化率_______,A的转化率__________,C的物质的量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g) +2B(s)![]() y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
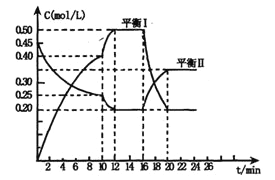
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=________;
(2)根据图示可确定x:y=_______________;
(3)0~l0min容器内压强_______________(填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是____________;第16min引起曲线变化的反应条件可能是____________;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中主要污染物SO2、NOx,为消除排放,保护环境,实现绿色可持续发展。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H1
NO(g)+1/2O2(g)=NO2(g) △H2
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3
SO3(g)+O2(g) △H3
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_________。
(2) 室温下,进入反应器的NO、SO2的物质的量恒定,改 变通入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):nNO)的变化见图。说明预处理过程中NO2的物质的量变化的原因_______,在反应中SO2的物质的量几乎不发生变化的原因是_______________。

(3)在一定条件下,SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
①0-5min内,用SO2表示的平均反应速率v(SO2)________。
②下列说法中能判断该反应达到平衡状态的是________
a.单位时间内生成nmolSO2同时生成nmolSO3
b.SO3和O2的物质的量浓度之比1:1
C.容器内压强保持不变
d.混合气体的密度不变
e.混合气体的平均相对分子质量不变
处理方法二: 也可采用NaClO2溶液作为吸收剂对烟气进行处理。在不同温度下,NaClO2溶液脱硫(S)、脱硝(N)的反应中,SO2和NO的平衡分压Pe如图所示。

(4) 由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”、“不变”或“减小”)。
(5) 反应ClO2-+2SO32-![]() 2SO42-+Cl-的平衡常数K表达式为_______。
2SO42-+Cl-的平衡常数K表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在300 K时,发生反应:A(g)+B(g)![]() 2C(g)+D(s),在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s),在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时生成a mol D ③A、B、C的物质的量浓度之比为1∶1∶2 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化
A. ③⑤ B. ②④⑤ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法中,正确的是

A. X和Y最多可形成4种化合物
B. YZ2分子的空间构型是V形
C. W和Z形成的共价化合物WZ4在常温下是固体
D. W、X、Y、Z的最简单氢化物中,W的氢化物沸点最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com