
| 催化剂 |
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
| c2(SO2)c(O2) |
| c2(SO3) |
| ||
| 6min |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
| A、开发、使用新能源 |
| B、大量使用农药,提高粮食产量 |
| C、禁止未经处理的工业废水和生活污水的任意排放 |
| D、用天然气代替汽油和柴油作发动机燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、200mL 1mol/L Fe2 (SO4)3溶液中,Fe3+和SO
| ||
| B、1molNO2与足量H2O反应,转移的电子数为NA | ||
| C、1mol CnH2n+2中含有的共用电子对数目为(3n+2)NA | ||
| D、S2和S8的混合物共6.4g,其中所含硫原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义.
在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义.| 组别 | c(一元酸) | c(NaOH) | 混合溶液的pH |
| 甲 | c(HY)=0.1mol/L | 0.1mol/L | pH=7 |
| 乙 | c(HZ)=0.1mol/L | 0.1mol/L | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的不饱和度为
的不饱和度为 的系统命名为
的系统命名为查看答案和解析>>
科目:高中化学 来源: 题型:
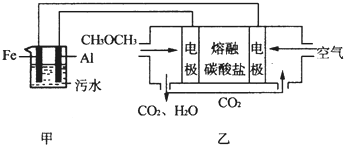
查看答案和解析>>
科目:高中化学 来源: 题型:
 铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:
铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为: 2- 4 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl-离子中含有的电子数为8nA |
| B、标准状况下,2.24 L H20中含有的分子数为nA |
| C、27g铝与足量的氧气反应,转移的电子数为3nA |
| D、0.2 mo1?L-1 Ca(NO3)2溶液中含有的N03-离子数为0.4nA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com