
【题目】足量的铜和含有2.4×10-3mol硝酸的某浓硝酸完全反应,共收集到标准状况下气体体积22.4 mL。参加反应的铜的质量是( )
A. 38.4×10-3gB. 44.8×10-3gC. 48.3×10-3gD. 57.6×10-3g
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】研究表明气孔的张开与保卫细胞膜上的H+—ATPase有着非常密切的关系。H+—ATPase被蓝光诱导激活后就会利用ATP水解释放的能量将H+分泌到细胞外,此时内向K+离子通道开启,细胞外的K+转移进保卫细胞;同时其他相关阴离子在H+协助下也进入保卫细胞,从而使气孔张开。气孔张开运动的相关机理如下图所示。
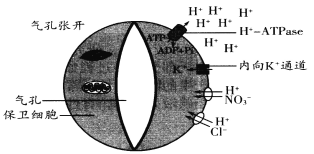
注:图中两个细胞贴近气孔部分细胞壁较厚,伸缩性较小,外侧较薄
(1)保卫细胞膜上的H+—ATPase被激活时,细胞内的H+通过____________的方式转移出保卫细胞;据细胞吸水与失水的原理推测,蓝光诱导后气孔张开的原因是__________________。
(2)植物有时为防止水分过度散失气孔会关闭,此时叶肉细胞仍可进行光合作用,消耗的CO2可来自___________和___________,但光合速率会明显减慢;气孔开启瞬间植物叶肉细胞消耗C5的速率会___________(填“增大”或“减小”或“不变”)。
(3)科研人员利用转基因技术在拟南芥保卫细胞中表达了由光控制的K+通道蛋白BL,试图提高气孔动力,即光照增强时气孔打开的更快,光照减弱时关闭的也更快。
①欲探究BL蛋白是否发挥了此功能,可在变化的光照强度和恒定光照强度下,分别测正常植株和转基因植株的气孔动力,该实验的自变量是_____________________。
②若实验表明BL蛋白发挥了预期的作用,而在恒定光照强度下生长的转基因株系生物量积累和用水效率方面,与正常植株无明显差异,说明____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
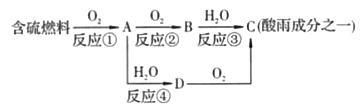
回答下列问题:
①酸雨的pH________(填“>”“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为___________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________,反应中氧化剂是___________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
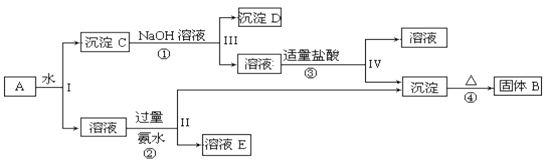
据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___________________。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式沉淀固体B________________;C______________________;E_______________
(3)写出①、②、④三个反应方程式(有离子反应的写离子方程式,没有的写化学方程式)
①____________________________ ② ____________________________
④__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
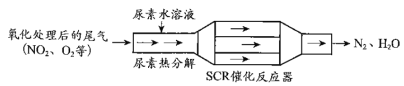
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________________。
②反应器内NH3还原NO2过程中,若还原产物比氧化产物少1mol,转移电子总数__________个(用NA表示)。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成_________。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
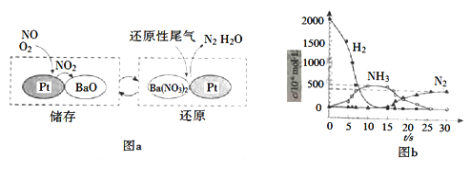
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是___。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_____________![]() 15NNO+H2O
15NNO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。
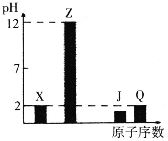
根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__。比较X、Y、Z的简单离子半径大小为__<____<__(用离子符号表示);
(2)元素的非金属性Y__J(填“>”或“<”)。下列各项中,不能说明这一结论的有__(填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____(填化学式);酸根呈三角锥结构的酸是___(填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com