
下列氧化还原反应中,水作为氧化剂的是( )
|
| A. | 3NO2+H2O═2HNO3+NO | B. | CO+H2O |
|
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①可以判断该分解反应已经达到平衡的是________(填字母序号)。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH____0(填“>”、“=”或“<”),熵变ΔS____0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如下图所示。
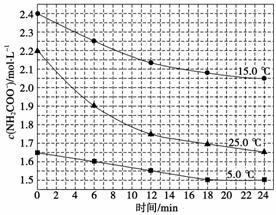
①计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:__________。
②根据图中信息,如何说明该水解反应速率随温度升高而增大:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素随核电荷数的增加,下列叙述正确的是( )
A. 单质的颜色逐渐加深
B. 气态氢化物的稳定性逐渐增强
C. 单质的熔点逐渐升高
D. 单质的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 2mol CH4的质量和O2的摩尔质量都是32g |
|
| B. | 1mol任何气体中都含有相同的原子数 |
|
| C. | 0.5molNaCl约含有6.02×1023个离子 |
|
| D. | 1mol/LKCl溶液中含有溶质1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液
②是胶体
③能产生丁达尔效应
④能透过滤纸
⑤不能透过滤纸
⑥静置后,会析出黑色沉淀.
|
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 所有主族元素正化合价数,等于它的族序数 |
|
| B. | ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
|
| C. | ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
|
| D. | 前三周期元素中共有非金属元素12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中, 是氧化剂; 是还原剂; 元素被氧化; 元素被还原; 是氧化产物; 是还原产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
诺贝尔化学奖获得者泽维尔研究了氢气和二氧化碳的反应:H 2 +CO 2 ====CO+H 2 O,此反应在一定条件下经历了一个相对长的中间状态HCOOH。下列叙述正确的是( )
A.H 2 的还原性一定比CO强
B.CO还原性一定比H 2 强
C.反应条件对物质的还原性存在影响
D.以上反应不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
沼气、天然气的主要成分是甲烷,下列叙述正确的是( )
A. CH4具有同分异构现象
B. CH4可使澄清石灰水变浑浊
C. CH4与Cl2在光照条件下能反应
D. CH4是由离子键形成的碳氢化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com