
分析 (1)含有弱离子的盐能发生水解,弱酸(或弱碱)越弱,水解程度越大,水解是微弱的,酸越弱对应阴离子水解程度越大;
(2)酸对水的电离有抑制作用,据KW计算出水电离出来的氢氧根离子浓度,水电离出的氢离子和氢氧根离子浓度相等,据此求算;
(3)向氨水中加入氯化铵抑制一水合氨电离;
(4)将等体积的③和④的溶液混合后,得到氯化铵为强酸弱碱盐,其溶液呈酸性.
解答 解:(1)含有弱离子的盐能发生水解,碳酸钠和碳酸氢钠都是含有弱离子的盐,能发生水解;在发生水解反应的溶液中pH最大的是②碳酸钠溶液,
故答案为:①②;②;
(2)取10mL溶液0.5mol/L的盐酸,加水稀释到500mL,c(H+)=$\frac{0.5mol/L×0.01L}{0.5L}$=0.01mol/L,据常温下水的离子积常数可知,c(OH-)水=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,所以水电离出来的氢离子浓度为10-12mol/L,
故答案为:10-12mol/L.
(3)向氨水中加入氯化铵,溶液中铵根离子浓度增大,抑制一水合氨电离,氢氧根离子浓度减小,一水合氨浓度增大,所以溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$的值减小,
故答案为:减小;
(4)将等体积的③和④的溶液混合后,氯化铵为强酸弱碱盐,铵根离子水解其溶液呈酸性,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评 本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性结合守恒思想分析解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1H、2H、3H、H2都是氢元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
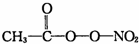 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO均为酸性氧化物 | B. | 稀豆浆、氯化铁溶液均为胶体 | ||
| C. | 冰醋酸、四氯化碳均为电解质 | D. | 食醋、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1010:1 | B. | 5×109:1 | C. | 108:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+CO2↑+H2O | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
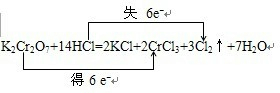
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| B. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于金属元素 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{49}$Y和${\;}_{39}^{50}$Y是两种不同的核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com