
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
【答案】①②⑧ ③⑦ ①④⑤⑥ NaHSO4 = Na++H++ SO42- CO32-+Ca2+=CaCO3↓ 1 4 1 1 2 3 1 2 3
【解析】
(1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解;能导电的物质中含有自由移动的电子或离子,据此解答;
(2)①硫酸氢钠为强电解质,水溶液中完全电离产生钠离子、氢离子和硫酸根离子;②碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
(3)首先分析元素化合价变化,再依据氧化还原反应得失电子守恒配平方程式。
(1)①熔融的NaCl中含有自由移动的离子,能够导电;在水溶液里或熔融状态下能导电,属于电解质;②液态HCl中不含自由移动的离子和电子,不导电;在水溶液里能导电,属于电解质;③蔗糖中不含自由移动的离子和电子,不导电;在水溶液里和熔融状态下都不导电,是非电解质;④汞是单质,含有自由移动的电子,能够导电,既不是电解质,也不是非电解质;⑤Na2OH溶液中含自由移动的离子能够导电;是混合物,既不是电解质,也不是非电解质;⑥稀硫酸溶液中含自由移动的离子能够导电;是混合物,既不是电解质,也不是非电解质;⑦CO2中不含自由移动的离子和电子,不导电;本身不能电离产生自由移动的离子,是非电解质;⑧KCl晶体中不含自由移动的离子和电子,不导电;在水溶液里或熔融状态下能导电,属于电解质;属于电解质的是①②⑧;属于非电解质的是③⑦;能导电的有①④⑤⑥;故答案为:①②⑧;③⑦;①④⑤⑥;
(2)①硫酸氢钠为强电解质,水溶液中完全电离产生钠离子、氢离子和硫酸根离子,电离方程式:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
②苏打和澄清石灰水反应的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,Na2CO3、Ca(OH)2、NaOH都改写成离子,CaCO3难溶于水以化学式保留,离子方程式为:Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
(3)①Fe元素的化合价由0价升至Fe(NO3)3中的+3价,升高3价,N元素的化合价由HNO3中的+5价降至NO中的+2价,降低3价,根据元素化合价升降总数相等配平:1Fe+1HNO3→1Fe(NO3)3+1NO↑+H2O;观察Fe(NO3)3中N元素的化合价与HNO3中N元素的化合价一致,根据原子守恒调整HNO3的化学计量数,进而确定H2O的化学计量数,配平为:1Fe+4HNO3=1Fe(NO3)3+1NO↑+2H2O,故答案为:1;4;1;1;2;
②反应中碳元素化合价从+2价升高为+4价,铁元素从+3价降为0价,依据氧化还原反应得失电子守恒、原子个数守恒方程式:3CO+Fe2O3═2Fe+3CO2,故答案为:3;1;2;3。


科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
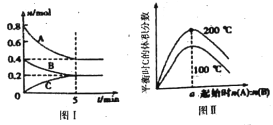
A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备硅单质时,主要化学反应如下:
(1)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(2)Si+2Cl2![]() SiCl4
SiCl4
(3)SiCl4+2H2![]() Si+4HCl
Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
A. (1)(3)为置换反应 B. (1)(2)(3)均为氧化还原反应
C. (2)为化合反应 D. 三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见无色无味液体, E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是漂白液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
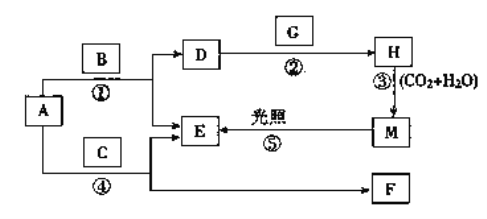
请回答下列问题:
(1)写出G、H的化学式:G________,H________。D的俗名是__________。
(2)写出反应②的离子方程式:_________________________________________。
(3)利用下图装置进行实验,证明氧化性强弱:KMnO4>Cl2>Br2。
限选试剂:KBr溶液、KMnO4、浓盐酸。
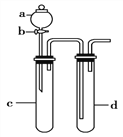
已知:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+8H2O
请回答下列问题:
装置a 的名称是____________________,d中盛放的试剂是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
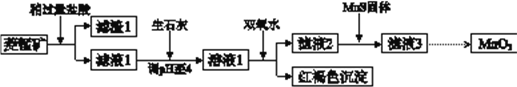
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显____(填“酸性、中性、或碱性”),理由是(用离子方程式表示):_______。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中(H+)_____(填“<”“>”或“=”)0.11mol/L,理由是____________。
(3)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为______________。
(4)某温度下,纯水中的c(H+)=4.0×10-7mol/L,若温度不变,滴入稀NaOH溶液,使c(OH-)=5.0×10-6moL/L,则溶液的c(H+)=______mol/L;pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa 溶波的pH_____NaOH溶液的pH(填“>”“=”或“<”);
II.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
(5)若处理后的废水中残留的c(Fe3+)=4.0×10-13mol/L,则残留的Cr3+的浓度为____mo/L(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-33)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中常含有少量的泥沙及氯化钙、氯化镁、硫酸盐等一些可溶性的杂质。粗盐的提纯实验操作步骤如下图所示:
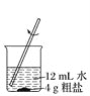

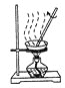
① ② ③
(1)请写出图中各步实验操作的名称①________,②________,③________。
(2)实验操作②的主要目的是____________________。
(3)实验操作③的目的是________________________。
(4)实验操作①②③中都使用的仪器是________,它在③中其作用是____________________。
(5)通过上述实验操作,得到的精盐中可能含有的杂质是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com