
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1 可知,金刚石比石墨稳定 | |
| C. | 在101 KPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
分析 A.等质量的硫蒸气具有的能量比硫固体多;
B.能量越低越稳定;
C.2g氢气是1mol,注意热化学方程式的化学计量数;
D.浓硫酸溶解放热.
解答 解:A.等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故A错误;
B.从热化学方程式看,石墨能量低,物质所含能量越低越稳定,故B错误;
C.2g氢气是1mol,热化学方程式应为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,故C错误;
D.浓硫酸溶解放热,所以将含0.5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,故D正确.
故选:D.
点评 本题考查反应热与焓变,综合考查学生对化学反应与能量变化的理解,为高考常见题型,注意相关基础知识的积累,注意把握问题的角度,理解物质的聚集状态与能量的关系、稳定的大小比较以及电解质的电离等问题,题目难度不大.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题

| A. | HR为强酸 | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c( NH4+)>c( R-)、c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 0.3 mol FeBr2与0.4 mol Cl2在溶液中反应:8Cl2+6Fe2++10Br-=6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-=Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
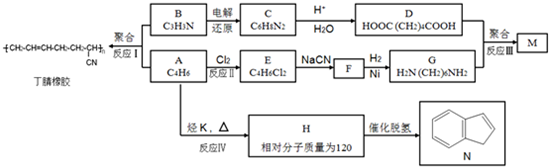
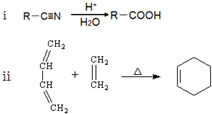
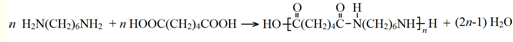 .
.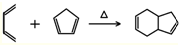 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Mg2+、NO3-、Cl-可以大量共存 | |
| B. | 该溶液能使淀粉碘化钾试纸变蓝,反应的离子方程式为:Fe3++2I-═Fe2++I2 | |
| C. | 该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 该溶液与足量铜粉反应的离子方程式为:3Cu+2Fe3+═2Fe+3Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(0H)2溶于氨水:Cu(0H)2+4NH3=[Cu(NH3)4]2++20H- | |
| B. | 足量的SO2通入Ca(C10)2溶液:Ca2++2C10-+S02═CaS04↓+2C1- | |
| C. | H2S04溶液与Ba(0H)2溶液反应:Ba2++0H-+H++S0${\;}_{4}^{2-}$═BaSO4↓+H20 | |
| D. | NaHC03溶液与过量澄清石灰水反应:2HC0${\;}_{3}^{-}$+Ca2++20H-═CaC03↓+CO${\;}_{3}^{2-}$+2H20 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是
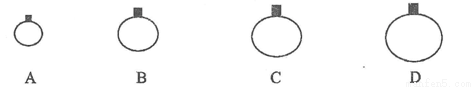
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
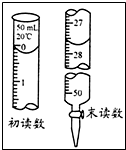 甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com