
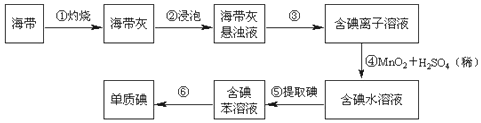
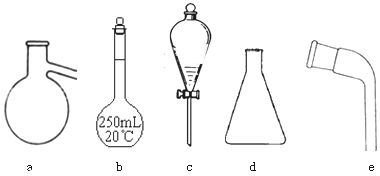
分析 (1)根据实验仪器的功能和使用方法进行判断,一般带有活塞或玻璃塞的仪器使用前需要检验是否漏水;
(2)根据实验操作步骤①灼烧来分析用到的实验仪器;
(3)根据实验操作步骤③过滤来分析用到的实验仪器;
(4)分离互溶的两种液体用蒸馏,蒸馏所需的玻璃仪器有蒸馏烧瓶、冷凝管、温度计、锥形瓶和接液管.
解答 解:(1)蒸馏烧瓶用于蒸馏、分液漏斗用于萃取、分液,二者可用于物质的分离,一般带有活塞或玻璃塞的仪器使用前需要检验是否漏水,因此分液漏斗和容量瓶使用前需要检验是否漏水,
故答案为:蒸馏烧瓶、分液漏斗;bc;
(2)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,
故答案为:BDE;
(3)步骤③是分离固体和液体,则实验操作为过滤,故除铁架台、烧杯外,还需用到的仪器有漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
(4)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏;蒸馏所需的玻璃仪器有蒸馏烧瓶、冷凝管、温度计、锥形瓶和接液管,
故答案为:蒸馏; 冷凝管、温度计.
点评 本题考查海带成分中碘的检验实验,明确物质的分离方法及碘单质的检验是解答的关键,难度适中,注重考查学生解决实际问题的能力.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2;△H3<△H4 | B. | △H1>△H2;△H3>△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{32m}{n}$ | B. | $\frac{16m}{n}$ | C. | $\frac{32n}{m}$ | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| B. | 为防止臭氧空洞的扩大,联合国环保组织要求各国大量减少CO2的工业排放量 | |
| C. | 棉花、蚕丝和锦纶的主要成分都是纤维素 | |
| D. | 为了防止中秋月饼等富含脂食品氧化变质,延长保质期,可以包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHB的存在抑制了水的电离 | |
| B. | HB-水解方程式:HB-+H2O?H3O++B2- | |
| C. | 相同物质的量浓度溶液的pH值:NaHB>Na2B | |
| D. | 溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com