
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子物质的量浓度为( )
A. 2(2b-a)/V mol·L-1 B. (2b-a)/V mol·L-1 C. 2(b-a)/V mol·L-1 D. (b-a)/V mol·L-1
科目:高中化学 来源: 题型:
【题目】为了探究氨气及氨水的还原性,某兴趣小组同学设计了以下探究活动。
I.探究氨气的还原性
该兴趣小组同学利用以下装置(夹持,加热仪器略)探究氯气与氨气的反应,其中A、F分别为氯气和氨气的发生装置,B为纯净干燥的氯气与氨气反应的装置。
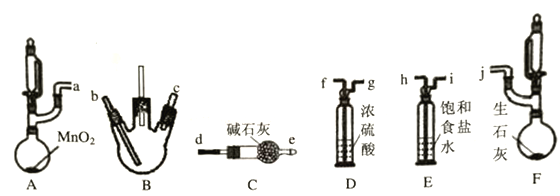
请回答下列问题:
(1)上述装置接口的连接顺序为a接h、i接f、g接___、____接___、____接j,其中装置D的作用是____________。
(2)若氨气足量,装置B中出现的现象为____________。
II.探究氨水的还原性
该兴趣小组同学探究不同条件下高锰酸钾溶液与氨水的反应,实验如下:
实验 | 操作 | 现象 |
① | 取2mL.0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
② | 取2mL0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约2min后溶液紫红色完全退去 |
③ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封ImL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
④ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加人半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约5min后溶液紫红色完全退去 |
(3)实验①中氧化产物为N2,写出该反应的离子方程式:_________。
(4)实验①②说明________________。
(5)实验②比实验④反应速率_____(填“快“或“慢”),原因是_________。
(6)1:5的硫酸溶液(密度为ρ2g·cm-3),可用质量分数为98%的浓硫酸(密度为ρ1g·cm-3)和
蒸馏水按体积比1:5配成,则该1:5的硫酸溶液的物质的量浓度为_____mol/L。(用含ρ1、ρ2的式子表示)
(7)由实验I、II可得出的结论是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A. 向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B. 向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有SO![]()
C. 向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D. 向某溶液中加入氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,说明原溶液中有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100 mL 4 mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现。若取等质量的该混合物,用足量的CO还原可得铁单质的质量为
A.2.8g B.5.6g C. 8.4g D.11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)现有A、B两种有机物的液体混合物,如果A、B互溶,且互相不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。分离A、B的混合物的常用方法是:________,需要的玻璃仪器除酒精灯、温度计外有_______、________、________、________。
(II)某课外小组需要配制95mL浓度为1 mol/L的NaCl溶液
(1)需要称取NaCl固体的质量为________g。
(2)在配制1 mol/L的NaCl溶液过程中,下列情况对氯化钠溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)。
①未经冷却趁热将溶液注入容量瓶中________;
②定容后有少量NaCl溶液洒出________;
③定容时仰视观察液面________。
(3)若预将100 mL 12mol/L的盐酸稀释为6mol/L的盐酸,需要加入水的体积为________mL。(已知:12mol/L的盐酸密度为1.19g/mL,6mol/L的盐酸密度为1.1g/mL,水的密度为1.0g/mL)。
(III)过氧化钠可用于呼吸面具中作为氧气的来源,在此过程中主要发生的化学反应方程式为_______________________;当氧气生成22.4L(标准状况下)时,转移电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国首艘国产航母于2017年4月顺利下水。制造航母需使用大量特种钢材、复合材料及光纤等。

①HSLA-100是一种航母甲板用钢,不属于这种钢材性质的是_________________(填字母)。
a.强度大 b.耐高温 c.密度小
②航母拦阻索最初由剑麻纤维和钢丝编织而成,现以尼龙和钢丝编织为主,下一代采用材质将是碳纤维。下列属于天然高分子材料的是__________________(填字母)。
a.剑麻纤维 b.尼龙 c.碳纤维
③航母信息系统上大量使用光导纤维,光导纤维的成分是________(填字母)。
a.3CaO·SiO2 b.SiO2 c.聚异戊二烯
(2)压缩鱼粉是由鱼粉、淀粉、水、山梨酸钾等配料加工而成,鱼粉中含有丰富的蛋白质、维生素及矿物元素钙、锌、硒、磷等。
①配料中,属于防腐剂的是___________________(填名称);钙、锌、硒、磷四种元素中属于微量元素的是___________________(填元素名称)。
②鱼粉蛋白质水解能生成多种氨基酸,写出甘氨酸的结构简式:___________________。
③配料中淀粉在人体中完全水解的化学方程式为_____________________。
(3)化学科学与污染防治及绿色发展密切相关。
①用清洁能源替代传统的化石能源是预防酸雨的有效途径之一。通常人们所说的酸雨,其主要有害成分是_____________________(填两种强酸的化学式);积极推广可降解塑料,减少使用聚乙烯等塑料,可防治的环境污染称为_____________________。
②纳米铁可修复被C2HCl3、NO![]() 污染的地下水。C2HCl3在纳米铁作用下,Cl被H取代最终转化为一种气态烃,该气态烃的结构简式为_____________________;NO3-在酸性条件下被纳米铁还原为N2(Fe被氧化为Fe2+)的离子方程式为_____________________。
污染的地下水。C2HCl3在纳米铁作用下,Cl被H取代最终转化为一种气态烃,该气态烃的结构简式为_____________________;NO3-在酸性条件下被纳米铁还原为N2(Fe被氧化为Fe2+)的离子方程式为_____________________。
③绿色合成是从源头上防治污染的前沿学科。水杨酸与(CH3CO)2O在绿色催化剂明矾催化下可生成阿司匹林和乙酸,该反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下:

(1) “溶解”时加热的目的是_____________________;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是_____________________。
(2) “过滤、洗涤”时,能说明沉淀已洗涤干净的依据是_____________________。
(3)按以下步骤可以测定产品中草酸根的质量分数。
①称取0.1600g草酸亚铁于锥形瓶中,加入25mL2mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O![]() +2MnO
+2MnO![]() +16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL2mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL1mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe![]() ) ∶n(C2O
) ∶n(C2O![]() ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O![]() 的质量分数(写出计算过程)。______________
的质量分数(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )

A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号内为实验室某浓盐酸试剂瓶标签上的有关数据,试根据有关数据回答下列问题:
(盐酸 分子式:HCl 相对分子量:36.5 密度:1.2 g/mL HCl质量分数:36.5%)
(1)该浓盐酸中HCl的物质的量浓度为______________。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是________(填字母)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.4 mol·L-1的稀盐酸。可供选用的仪器有:胶头滴管、玻璃棒、烧杯、药匙、量筒、托盘天平。
①配制稀盐酸时,还缺少的仪器有______________(写仪器名称);该仪器上标有以下五项中的______ (填字母)。
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②该学生需要量取__________mL上述浓盐酸进行配制。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面。(____)
b.量筒量取浓盐酸后又用蒸馏水洗涤2~3次,并将洗液移入容量瓶中。(____)
(4)①假设该同学成功配制了0.4 mol·L-1的盐酸,他又用该盐酸中和含0.4 g氢氧化钠的溶液,则该同学需取__________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g 氢氧化钠的氢氧化钠溶液,发现比①中所求体积偏小,则可能的原因是____________________________(填字母)。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com