
| A. | Na2CO3固体 | B. | NaCl溶液 | C. | 浓H2SO4 | D. | KNO3溶液 |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,锌与浓硫酸以及硝酸反应不生成氢气,以此来解答.
解答 解:A.碳酸钠与酸反应,生成氢气的量减少,故A错误;
B.加入NaCl溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故B正确;
C.浓硫酸与锌反应不生成氢气,故C错误;
D.加硝酸钠,氢离子、硝酸根离子与Zn发生氧化还原反应不生成氢气,减少生成氢气的量,故D错误.
故选B.
点评 本题考查影响化学反应速率的因素,明确浓度对反应速率的影响即可解答,题目难度不大,注意锌与浓硫酸以及硝酸反应不生成氢气.


科目:高中化学 来源: 题型:多选题
| A. | 可能是N2与NO2的混和气体 | B. | 可能是N2与NO的混和气体 | ||
| C. | 可能是NO与NO2的混和气体 | D. | 可能是NO2一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

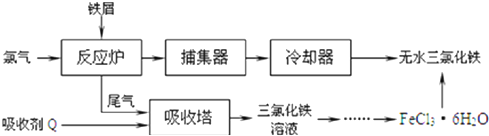
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的路线如下图所示:
)的路线如下图所示:
 +3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$ +NaCl+2H2O;
+NaCl+2H2O;  ,写出其余的同分异构体的结构简式
,写出其余的同分异构体的结构简式 、
、 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该晶体属于离子晶体 | |
| B. | 晶体的化学式为BaO2,所以晶体中阴阳离子个数比1:2 | |
| C. | 若将晶胞中阴阳离子位置互换,其图形依然可以看作该晶体的晶胞结构图 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、氯化钾等晶体易溶于水 | |
| B. | 氯气在加压、降温时会变成液氯或固氯 | |
| C. | 融化的铁水降温可铸成铁锭 | |
| D. | 金刚石有相当大的硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:B<A | B. | 离子的还原性:C2->D- | ||
| C. | 氢化物的稳定性:H2C>HD | D. | 质子数:c>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com