
| A. | ①②③④ | B. | 只有②③ | C. | ①②③ | D. | ②③④ |
分析 先根据反应方程式2Fe+3Br2=2FeBr3 2Fe3++2I-=2Fe2++I2 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,判断离子间的氧化性强弱,当离子的氧化性大于铁离子时,亚铁离子才能够被氧化成铁离子,注意在酸性条件下硝酸根离子检验氧化性,据此完成本题.
解答 解:由题中反应方程式可知,离子的氧化性关系为:Br2>Fe3+>I2,HNO3>Fe3+,
①、Fe(NO3)2溶液滴入硫酸中,硝酸根离子在酸性条件下具有氧化性,能够将亚铁离子还原成铁离子,故①正确;
②Fe(NO3)2溶液滴入硝酸中,硝酸检验强氧化性,能发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故②正确;
③Fe(NO3)2溶液滴入溴水中,由于氧化性Br2>Fe3+,所以溴单质能够将亚铁离子氧化成铁离子,故③正确;
④Fe(NO3)2溶液滴入碘水中,由于氧化性Fe3+>I2,所以碘单质不能够氧化亚铁离子,故④错误;
故选C.
点评 本题考查了铁盐与亚铁盐的相互转变、氧化还原反应中氧化性强弱比较等知识,题目难度不大,注意硝酸根离子在酸性条件下具有强氧化性,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
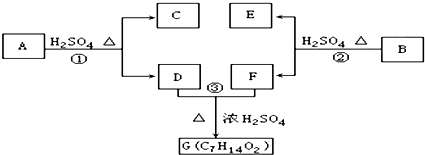
 ;
; ;
; ;写出生成G的化学方程式CH3CH2CH2COOH+
;写出生成G的化学方程式CH3CH2CH2COOH+ $→_{△}^{浓硫酸}$CH3CH2CH2COOCH(CH3)2+H2O.
$→_{△}^{浓硫酸}$CH3CH2CH2COOCH(CH3)2+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O与Na2O2均可与盐酸反应,故二者皆为碱性氧化物 | |
| B. | Na2O与Na2O2不可以相互转化 | |
| C. | 取一块金属钠放在燃烧匙里加热,金属先熔化,燃烧时火焰呈黄色,生成淡黄色固体 | |
| D. | 在呼吸面具中,Na2O2常作供氧剂,而Na2O不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液与足量CO2反应:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解可制得葡萄糖 | |
| B. | 用硅酸钠溶液与稀盐酸反应可制得硅酸 | |
| C. | 二氧化锰和稀盐酸混合加热可制得氯气 | |
| D. | 将饱和氯化铁溶液加热至沸腾可制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的质量 | |
| B. | 物质的量不是国际单位制的七个基本物理量之一 | |
| C. | 物质的量是摩尔的单位 | |
| D. | 阿伏加德罗常数的数值约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质电离方程式为NaHCO3═Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com