
| A. | Fe2O3与HCl反应 | B. | 过量铁粉与稀硝酸反应 | ||
| C. | 少量铁粉与稀盐酸作用 | D. | 铁粉与CuSO4反应 |
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: | B. | 8个中子的碳原子的符号:12C | ||
| C. | 次氯酸分子的结构式:H-O-Cl | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含硫酸的废液倒入水槽,用水冲入下水道 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 温度计不慎打破,散落的水银应用硫粉处理后收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
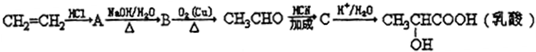
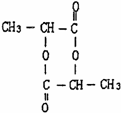 、两分子成链状酯
、两分子成链状酯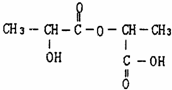 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
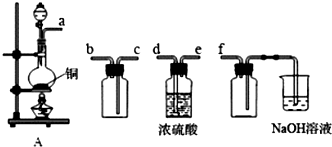
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5 种离子 | |
| B. | SO42-、NH4+、Fe3+、一定存在,Cl-、K+、Al3+可能存在 | |
| C. | K+一定存在,Al3+可能存在 | |
| D. | Cl-一定存在,且c(Cl-)≥0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com