

分析 装置A为SO2的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以C为尾气吸收装置,吸收未反应的SO2,应该盛放碱性物质,一般采用NaOH溶液;
(1)仪器A的名称蒸馏烧瓶,Na2S2O3•5H2O易溶于水,难溶于乙醇,步骤④中洗涤时要减少该物质的溶解;
(2)NaOH溶液具有碱性,能吸收酸性气体;
(3)Na2S2O3在酸性条件下反应生成S、SO2和水;
(4)SO42-用盐酸酸化的BaCl2溶液检验;
(5)2 S2O32-+I2=S4O62-+2I-中硫代硫酸根离子和碘的关系式计算n( S2O32-),再根据m=nM计算其质量,硫代硫酸钠纯度=$\frac{硫代硫酸钠质量}{样品质量}×100%$;
(6)Na2S2O3在溶液中易被Cl2氧化成SO42-,氯气被还原生成氯离子,根据反应物和生成物书写离子方程式.
解答 解:装置A为SO2的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以C为尾气吸收装置,吸收未反应的SO2,应该盛放碱性物质,一般采用NaOH溶液;
(1)仪器A的名称蒸馏烧瓶,Na2S2O3•5H2O易溶于水,难溶于乙醇,步骤④中洗涤时要减少该物质的溶解,所以洗涤时用乙醇洗涤,故答案为:蒸馏烧瓶;乙醇;
(2)二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以C为尾气吸收装置,吸收未反应的SO2,故答案为:吸收SO2尾气,防止污染空气;
(3)Na2S2O3在酸性条件下反应生成S、SO2和水,离子方程式为S2O32-+2H+═S↓+SO2↑+H2O,故答案为:S2O32-+2H+═S↓+SO2↑+H2O;
(4)SO42-用盐酸酸化的BaCl2溶液检验,其检验方法为:取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,反之,不含,
故答案为:取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,反之,不含;
(5)2 S2O32-+I2=S4O62-+2I-中硫代硫酸根离子和碘的关系式得n( S2O32-)=0.1000mol/L×0.016L×2=0.0032mol,根据S原子守恒得n( S2O32-)=n(Na2S2O3•5H2O)=0.0032mol,m(Na2S2O3•5H2O)=nM=0.0032mol×248g/mol=0.7936g,硫代硫酸钠纯度=$\frac{硫代硫酸钠质量}{样品质量}×100%$=$\frac{0.7936g}{1.00g}$×100%=79.36%,
故答案为:79.36;
(6)Na2S2O3在溶液中易被Cl2氧化成SO42-,氯气被还原生成氯离子,根据反应物和生成物书写离子方程式为S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
点评 本题考查物质制备,为高频考点,涉及氧化还原反应、化学方程式的有关计算、离子检验、物质分离和提纯等知识点,综合性较强,明确基本原理、基本计算、基本性质是解本题关键,知道图中各个装置的作用及可能发生的反应,注意正确获取题给信息并灵活解答问题,题目难度中等.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
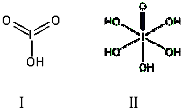
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑦⑧ | B. | ②③⑤⑦ | C. | ①②⑦⑧ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+和Fe2+ | B. | Al3+和Na+ | C. | Fe2+和NH4+ | D. | Fe3+和Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 材料是为人类社会所需要并能用于制造有用器物的物质 | |
| B. | 人类使用和制造材料有悠久的历史,制造出的第一种材料是陶 | |
| C. | 体型结构的酚醛树脂制成的塑料,加工成型后,受热熔化后还可以制成其它形状的器物 | |
| D. | 高分子分离膜是具有传统高分子材料的机械性能,又具有特殊分离功能的功能高分子材料制成的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:5 | C. | 1:9 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com