
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |
分析 酸和乙盐会生成硫酸钡,说明酸提供硫酸根离子,乙盐提供钡离子;酸碱生成硫酸钡,说明酸提供硫酸根离子,碱提供钡离子,采用排除的方法即可解答.分别将四种物质代入转换图中进行验证分析即可.
解答 解:根据题意可知,各种会反应的物质都生成了硫酸钡,
酸碱反应生成硫酸钡,酸中肯定有氢离子,酸就只会提供硫酸根离子,碱就提供了钡离子,可以排除A、D,
酸和乙盐反应也生成了硫酸钡,酸中肯定有氢离子,酸就只会提供硫酸根离子,乙盐中肯定有钡离子,可以排除A、D,
碱和甲盐也生成了硫酸钡,根据前面的推导可知,碱中有钡离子,甲盐中就一定有硫酸根离子,排除A、D,
BC中物质间的反应符合转化关系,
故选BC.
点评 本题主要考查了采用排除法解答物质的推断题,只要有一个地方不满足就可以排除该选项,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
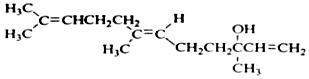 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
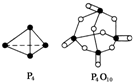 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 化学键 | P-P | P-O | O═O | P═O |
| 键能kJ/mol | 197 | 360 | 499 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b=14 | B. | a+b=13 | C. | a+b=15 | D. | a+b=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
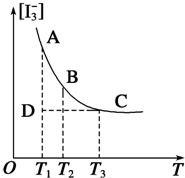 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
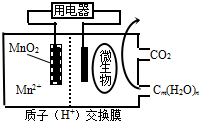
| A. | 放电过程中,H+从正极区移向负极区 | |
| B. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| C. | 微生物所在电极区放电时发生还原反应 | |
| D. | 左边电极反应式为:MnO2+4H++2e-=Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 18g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com