
 TiCl4+CO (未配平)
TiCl4+CO (未配平) TiCl4+CO______
TiCl4+CO______ TiCl4+CO,C中C元素化合价由0价升高为为+2价,1个CO化合价变化为2,Cl2中氯元素化合价由0价降低为-1价,1个TiCl4化合价变化为4,根据电子守恒,TiCl4的系数为1,CO的系数是2,再根据质量守恒得:TiO2+2C+2Cl2
TiCl4+CO,C中C元素化合价由0价升高为为+2价,1个CO化合价变化为2,Cl2中氯元素化合价由0价降低为-1价,1个TiCl4化合价变化为4,根据电子守恒,TiCl4的系数为1,CO的系数是2,再根据质量守恒得:TiO2+2C+2Cl2 TiCl4+2CO,元素化合价升高值等于元素化合价降低值=电子转移数=4,电子转移情况为:
TiCl4+2CO,元素化合价升高值等于元素化合价降低值=电子转移数=4,电子转移情况为: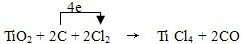 ,故答案为:
,故答案为: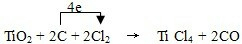 ;
;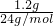 =0.05mol,由FeTiO3~TiO2~TiCl4~2Mg,得FeTiO3的物质的量为0.025mol,FeTiO3的质量为0.025mol×152g/mol=0.038g,所以钛铁矿中FeTiO3的质量分数
=0.05mol,由FeTiO3~TiO2~TiCl4~2Mg,得FeTiO3的物质的量为0.025mol,FeTiO3的质量为0.025mol×152g/mol=0.038g,所以钛铁矿中FeTiO3的质量分数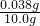 ×100%=38%,故答案为:38%.
×100%=38%,故答案为:38%.

科目:高中化学 来源: 题型:
 (2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:
(2009?清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)?2NH3(g) 已知298K时:△H=-92.4kJ?mol-1试回答下列问题:| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| △ |
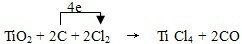
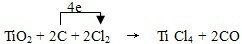
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。
Cu2O+H2↑,其装置如图,下列有关说法不正确的是___________。 


查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海闽行区模拟) (12分)Ag/α-Al2O3在石油化工生产中作为重要的催化剂,其中Ag起催化作用,α-Al2O3是催化剂载体且不溶于硝酸,工业生产使用后的催化剂中往往含有少量铁及铁的氧化物。若在实验室里对该催化剂进行回收得到α-Al2O3和AgNO3晶体,其流程如下图所示。其中的实验操作(Ⅴ)的转化反应为:6AgCl + Fe2O3 → 3Ag2O + 2FeCl3
阅读下述流程,完成下列填空:
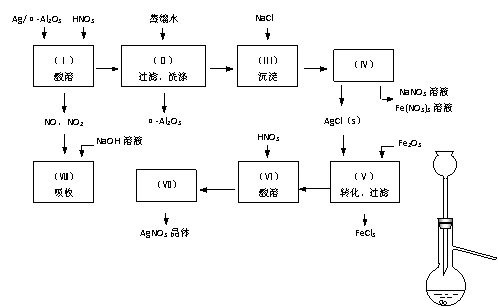 |
(1)Ag/α-Al2O3加酸溶解时若选用如右图装置,为使实验正常进行,需要对实验装置改进的是 。
(2)在实验操作(II)中,如果用自来水代替蒸馏水进行洗涤时,将会出现的问题是
。
(3)实验操作(Ⅳ)所需的玻璃仪器为 。
(4)实验操作(Ⅶ)从AgNO3溶液中获得AgNO3晶体需要进行的操作依次为
(选择并排序)。
a.蒸馏 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶
(5)已知:NO + NO2 + 2NaOH → 2NaNO2 + H2O
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
将实验操作(Ⅰ)中生成的NO、NO2混合气体通过实验操作(Ⅷ)中的NaOH溶液吸收,当它们的关系满足下列哪些关系时,混合气体能被完全吸收 (选填编号)。
a.V(NO2)>V(NO) b.V(NO2)< V(NO) c.V(NO2)= V(NO)
(6)已知催化剂(忽略杂质)中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为 和 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com