
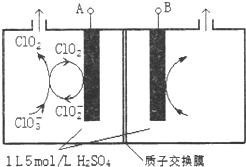
 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.分析 (1)反应物为亚氯酸钠,所在环境为酸性环境,生成物为ClO2气体,且知此反应为歧化反应,据此书写离子反应方程式即可;改加pH相同的硫酸,氢离子浓度不变,应考虑氯离子的影响;
(2)H2O2作还原剂时氧化产物为O2,不会产生环境污染;
(3)①与电源负极相连的一极为阳极,溶液中的阳离子在此电极得到电子,发生还原反应;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2;
③电解池中阴极得到的电子数等于阳极失去的电子数,根据阳极室发生反应:4OH--4e-=O2↑+2H2O,阴极发生:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O分析解答.
解答 解:(1)亚氯酸钠在强酸性溶液中会发生歧化反应,产生ClO2气体,故化合价由+3价升高到+4价,故部分氯离子降低为-1价,离子反应方程式为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O,反应开始时,溶液中氯离子浓度很小,随着反应的进行,溶液中氯离子浓度增大,反应速率加快,可见氯离子起催化作用,
故答案为:5ClO2-+4H+=4ClO2↑+Cl-+2H2O;反应生成的氯离子对该反应起催化作用;
(2)还可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备ClO2更受欢迎,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,不会产生环境污染,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2;
(3)①由图可知,ClO2在电极A上得到1个电子,生成ClO2-,故A应为电源的负极,故答案为:A;
②阴极室中电极A上发生反应ClO2+e-=ClO2-,生成的ClO2-与溶液中的ClO3-结合生成ClO2,离子反应方程式为:ClO3-+ClO2-+2H+=2ClO2↑+H2O,
故答案为:ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O;
③在电解池的整个闭合回路中阴极得到的电子数等于阳极失去的电子数,在阳极室发生反应:4OH--4e-=O2↑+2H2O产生1mol的O2,转移4mold电子,阴极室ClO2+e-=ClO2-;ClO3-+ClO2-+2H+=2ClO2↑+H2O每产生4mol的ClO2电子转移4mol电子,共产生气体5mol.现在两极共收集到气体22.4L(体积已折算为标准状况,忽略电解液体积的变化和ClO2气体溶解的部分),产生气体的物质的量为1mol,所以转移电子0.8mol,在阳极有0.8mol的OH--离子放电.阴极氢离子减少0.4mol,因为溶液的体积为1L,所以此时阳极室与阴极室c(H+)之差为1.2mol/L,
故答案为:1.2mol/L.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: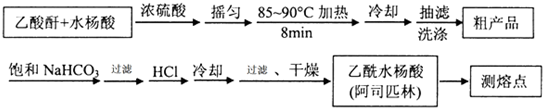
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com