
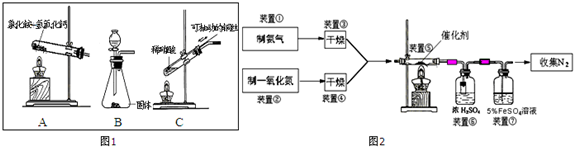
分析 (1)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,实验室制备少量氨气时可根据氨水的易挥发性和氧化钙的吸水性来制取;
(2)根据铜和稀硝酸反应生产硝酸铜和一氧化氮结合反应遵循电荷守恒、电子守恒以及质量守恒来书写离子方程式,用可抽动的铜丝易于控制反应,操作方便.
(3)硫酸亚铁吸收NO,生成配合物;
(4)根据n=$\frac{V}{{V}_{m}}$计算出反应生成的氮气的物质的量,然后利用电子守恒配平写出反应的化学方程式,根据放出的热量写出该反应的热化学方程式;
(5)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,根据质量守恒书写化学方程式.
解答 解:(1)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;实验室制备少量氨气时可根据氨水的易挥发性和氧化钙的吸水性来制取,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;浓氨水、碱石灰;
(2)铜和稀硝酸反应生产硝酸铜和一氧化氮,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;用可抽动的铜丝易于控制反应,操作方便并能节约药品,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;反应可以随时关停、操作方便、反复使用、节约药品;
(3)一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为:Fe2++NO=Fe(NO)2+,
故答案为:吸收未反应的NO;
(4)反应生成氮气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,反应共放热akJ,即:反应生成0.05mol氮气会放出akJ的热量,
NO中N元素的化合价为+2价,氨气中N元素的化合价为-3,反应后都生成氮气,化合价升高了3价、降低了2价,则NO与氨气的系数之比为3:2,氮气为双原子分子,则NO的系数为6、氨气的系数为4,然后根据质量守恒定律配平可得:6NO+4NH3?5N2+6H2O,
生成5mol氮气放热的热量为:$\frac{5mol}{0.05mol}$×akJ=100akJ,
所以该反应的热化学方程式为:6NO(g)+4NH3(g)?5N2(g)+6H2O (g);△H=-100a kJ/mol,
故答案为:6NO(g)+4NH3(g)?5N2(g)+6H2O (g);△H=-100a kJ/mol;
(5)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,反应方程式为:2Cu(OH)NH4CrO4$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3•2CuO+N2↑+5H2O,
故答案为:2Cu(OH)NH4CrO4$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3•2CuO+N2↑+5H2O.
点评 本题考查氨气的制取和性质,题目难度中等,试题较为综合,注意少量氨气制取的方法以及NO尾气的吸收等问题,试题侧重考查学生灵活应用基础知识的能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
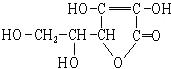
| A. | 分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 可以溶于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②③④ | B. | .①②③ | C. | ②③④ | D. | .① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们最早先根据味道,来获得朴素的酸、碱概念:酸一定有酸味的,碱一定是有涩味的 | |
| B. | 波义耳基于指示剂变色来分辨酸碱,酸一定能使石蕊变红,碱一定能使石蕊变蓝 | |
| C. | 阿累尼乌斯创立了酸碱电离理论,酸碱电离理论不适用于非水溶液 | |
| D. | 酸碱质子理论:凡是能给出H+的物质就是酸,凡是能结合H+的物质就是碱,这是酸、碱的最终定义 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
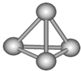 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )| A. | N4和N2互为同素异形体,两者之间的转化为非氧化还原反应 | |
| B. | 1mol N4分子的总能量比1mol N2分子的总能量高,说明相同条件下N4分子化学性质更稳定 | |
| C. | N4气体转化为N2的热化学方程式为:N4(g)═2N2(g),△H=-882 kJ•mol-1 | |
| D. | 白磷(P4)的熔、沸点比N4分子的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 500℃、30Mpa下,将0.5molN2和1.5molH2置于密闭容器中充分反应,放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2作为氧化剂得到的电子数为N0 | |
| B. | 1.0 mol•L-1 NaAlO2溶液中含有Na+数目为N0 | |
| C. | 1 mol的甲基与1 mol的羟基所含电子数均为9N0 | |
| D. | 92 g NO2、N2O4混合气体含有的分子数为2N0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com