
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质. 2NH3
2NH3| (2a)2 |
| a3×a |
| 4 |
| a2 |
| 4 |
| a2 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
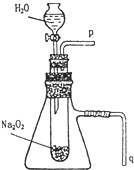 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
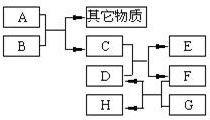 已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.
已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈紫色,F为深红棕色液体,H能使淀粉变蓝,它们之间的相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | FeSO4.7H2O | (NH4)2SO4 | (NH4)2SO4.FeSO4.6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com