
【题目】氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
B.(CN)2+H2O=2H++CN-+CNO-
C.(CN)2+2OH-=CN-+CNO-+H2O
D.(CN)2+2SCN-=2CN-+(SCN)2
【答案】B
【解析】
阴离子的还原性顺序为:Cl-<Br-<CN-<SCN-<I-,所以分子的氧化性为:Cl2 >Br2>(CN)2 >(SCN)2>I2,结合以上规律,根据卤素单质的性质进行分析。
A.MnO2能与浓盐酸反应制得氯气,说明二氧化锰的氧化性大于氯气,氯气的氧化性大于(CN)2,则反应4HCN(浓)+MnO2![]() Mn(CN)2+(CN)2↑+2H2O能进行,故A正确;
Mn(CN)2+(CN)2↑+2H2O能进行,故A正确;
B.卤素单质能与水反应,(CN)2与卤素单质的性质相似,则与水反应,发生(CN)2+H2O![]() HCN+HCNO,拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,所以在溶液中主要以分子形式存在,不能拆成离子,故B错误;
HCN+HCNO,拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,所以在溶液中主要以分子形式存在,不能拆成离子,故B错误;
C.(CN)2与卤素单质的性质相似,可以发生类似氯气与碱的反应,与碱发生反应(CN)2+2OH-=CN-+CNO-+H2O,故C正确;
D.还原性:CN-<SCN-,则(CN)2能氧化SCN-,即2SCN-+(CN)2=(SCN)2+2CN-,故D正确;
答案为B。
【点晴】
需要学生对信息应用进行利用,注意把握题中信息,“(CN)2、(SCN)2与卤素单质的性质相似”,可知拟卤素能与水、碱反应;拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,则在溶液中主要以分子形式存在,结合阴离子的还原性强弱顺序分析。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:

下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表达。
(1)小苏打受热易分解,化学方程式为__。
(2)金属钠着火不能用水扑灭,用离子方程式解释其原因__。
(3)工业上用氯气和熟石灰制备漂白粉,化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 。在含少量
。在含少量![]() 的溶液中,
的溶液中,![]() 分解反应过程为
分解反应过程为
i.![]()
ii.![]()
下列说法不正确的是
A. ![]()
B. ![]() 是
是![]() 分解反应的催化剂
分解反应的催化剂
C. 欲分解2mol![]() (l),至少需要提供
(l),至少需要提供![]() 的热量
的热量
D. 若生成![]() ,则反应ii转移电子的物质的量为
,则反应ii转移电子的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其原子序数依次增大,且质子数均小于18。A元素原子的最外层只有1个电子,该元素阳离子与N3-核外电子排布相同;B元素原子核外各轨道上均无成单电子;C元素原子的价电子排布为ns2np2;D-的核外电子构型与Ar相同。
(1)写出A、C、D的元素符号:A________,C________,D________。
(2)写出B元素电子的电子排布式________;D元素电子的电子排布图______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaC1O2的实验流程如图所示,反应I的化学方程式为: 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,下列说法正确的是

A.NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H2O2做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。

①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_______。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是____________(用序号填写)。

(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)![]() H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)![]() H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为______________。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式______。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是______________。
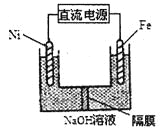
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是____________。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为____。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=______。

已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度![]() 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
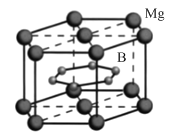
【题目】FeSe 、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态Se原子的电子占据最高能级的电子云轮廓图为________形。
(2)向FeSe中嵌入吡啶(![]() )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________。
②液氨是氨气液化的产物,氨气易液化的原因是________。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________。
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com