
【题目】I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为_________。
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含元素的第一电离能由大到小的顺序为___________,碳原子的轨道杂化类型为_______。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sr3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为___________。
Ⅱ.ZnCl2浓溶液常用于除去金属表面的氧化物,如与FeO反应可得 Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有________(填选项字母)。
A 离子键 B 共价键 C 金属键 D 配位键 E 范德华力 F 氢键
Ⅲ.某微粒的球棍模型如下图所示。
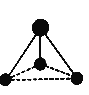
(5)已知含有1个碳原子和3个氢原子,请写出该微粒的化学式:_____。
Ⅳ.铜与氧元素形成的晶胞如下图所示:

(6)晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为___________,已知该晶体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为___________cm(列出计算式即可)。
【答案】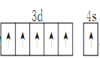 N>O>H>C sp3和sp2 没有未成对电子(d轨道上电子为全空或全充满) AC CH3— (
N>O>H>C sp3和sp2 没有未成对电子(d轨道上电子为全空或全充满) AC CH3— (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)Cr元素位于周期表第四周期ⅥB族,原子核外电子数为24,核外电子排布式为1s22s22p63s23p63d54s1,价电子轨道表达式为 ,故答案为:
,故答案为: ;
;
(2)甘氨酸的结构简式为NH2CH2COOH,该分子中所含的元素有H、C、N和O,同周期元素从左到右,元素第一电离能逐渐增大,但N原子的2p能级含有3个电子,为半满稳定状态,第一电离能较相邻元素高,则第一电离能的大小顺序为N>O>H>C;NH2CH2COOH分子中含有饱和碳原子和羧基不饱和碳原子,饱和碳原子为sp3杂化,羧基不饱和碳原子为sp2杂化,故答案为:N>O>H>C;sp3和sp2;
(3)Sc3+的电子排布式为1s22s22p63s23p63d,Cr3+的电子排布式为1s22s22p63s23p63d5,Fe2+的电子排布式为1s22s22p63s23p63d6,Zn2+的电子排布式为1s22s22p63s23p63d10,由电子排布式可知水合离子的颜色与d轨道未成对电子有关,没有未成对电子,即d轨道上电子为全空或全充满的Sc3+、Zn2+的水合离子为无色,故答案为:没有未成对电子(d轨道上电子为全空或全充满);
(4) Fe[Zn(OH)Cl2]2的水溶液中存在的微粒有Fe2+、[Zn(OH)Cl2]—和H2O,[Zn(OH)Cl2]—离子中存在配位键和氢氧共价键,H2O分子中存在氢氧共价键,H2O分子间存在范德华力和氢键,不存在离子键和金属键,故答案为:AC;
(5)由球棍模型可知,该微粒为三角锥形,说明C原子的价层电子对数为4,孤对电子数为3,则化学式为CH3—,故答案为:CH3—;
(6)由晶胞示意图可知,位于顶点的a和体心的b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),d位于体对角线的![]() 处,则d的坐标参数为(
处,则d的坐标参数为(![]() ,
,![]() ,
,![]() );晶胞中Cu原子的个数为4,O原子的个数为8×
);晶胞中Cu原子的个数为4,O原子的个数为8×![]() +1=2,则化学式为Cu2O,Cu2O的摩尔质量为144g/mol,设晶胞的参数为a,晶胞的质量为a3ρ=
+1=2,则化学式为Cu2O,Cu2O的摩尔质量为144g/mol,设晶胞的参数为a,晶胞的质量为a3ρ=![]() ,则a=
,则a=![]() cm,故答案为:(
cm,故答案为:(![]() ,
,![]() ,
,![]() );
);![]() 。
。


科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 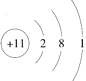
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是

A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
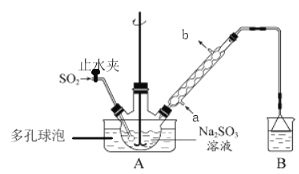
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上发生分解。
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,将装置A中导气管换成橡皮塞,在80~90℃下,反应约3h,冷却至室温,抽滤将剩余锌粉与难溶性产物除去。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___________(填字母代号);
A.NaOH溶液 B.NaHSO3溶液 C.饱和NaCl溶液
冷凝管中冷却水从___________(填“a”或“b”)口进水。
(2)A中多孔球泡的作用是_______________________________________________________。
(3)冷凝管中回流的主要物质除H2O外还有___________(填化学式)。
(4)写出步骤2中发生反应的化学方程式___________________________________________。
(5)步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止_________。
(6)为了测定产品的纯度,准确称取2.0 g样品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.233 g,则所制得的产品的纯度为_____(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:

(1)装置A中反应的化学方程式为___________。
(2)使分液漏斗中液体顺利流下的操作是___________。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是___________。
②丙同学设计的合理实验方案为:A→C→_____→___→D→F,其中装置C的作用是_____,证明亚硫酸的酸性强于次氯酸的实验现象是____。
(4)K2S2O3具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为_____。称取0.2500g产品于碘量瓶中,加100mL水溶解,再加入8.000g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以淀粉为指示剂,用cmol/L的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液VmL,则样品中K2S2O8的纯度为______%(用含c、V的代数式表示,已知:S2O82-+2I-=2SO42-+I2;2S2O32-+I2=S4O62-+2I-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下:

回答下列问题:
(1)丙二酸的结构简式为___________;E中含氧官能团的名称是___________。
(2)A遇FeCl3溶液发生显色反应,1 mol A和1 mol丙二酸在吡啶、苯胺中反应生成l mol B、1 mol H2O和1 mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为_______________________________________________________。
(3)D生成E的反应类型为_____________。
(4)已知碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出F中的手性碳:_______________。
(5)X是B的同分异构体,X同时满足下列条件的结构共有___________种(不考虑空间异构),其中核磁共振氢谱有五组峰的结构简式为______________。
①可与碳酸氢钠溶液反应生成二氧化碳;②遇FeCl3溶液发生显色反应;③除苯环外不含其他环。
(6)写出以苯甲醇和丙二酸为原料制备 的合成路线_________________。
的合成路线_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:

①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法错误的是
出发合成BHT的方法有如下两种。下列说法错误的是

A. 从绿色化学角度分析方法一优于方法二
B. 推测BHT在水中的溶解度小于苯酚
C. BHT与![]() 都能使酸性KMnO4褪色
都能使酸性KMnO4褪色
D. 方法一的反应类型是取代反应,方法二的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,下列有关叙述正确的是( )

A.HCl、H2CO3、H2SiO3的酸性依次增强
B.A中锥形瓶中生成CO2气体
C.B中装饱和Na2CO3溶液,用于除去A中挥发出的HCl气体
D.C中装Na2SiO3溶液,预期现象是先出现白色沉淀后又逐渐溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com