
| A. | SO2、NO2和CO2都属于酸性氧化物 | |
| B. | 甲烷和和一氯甲烷都属于烷烃 | |
| C. | 碱性氧化物都是金属氧化物 | |
| D. | 在水溶液中能电离出H+的化合物都属于酸 |
分析 A.酸性氧化物是指能与碱反应生成盐和水的氧化物;
B.烷烃属于烃类,组成元素只有碳元素和氢元素;
C.碱性氧化物是和酸反应生成盐和水的氧化物,发生的是复分解反应;
D.在水溶液中能电离出的阳离子全部是H+的化合物属于酸.
解答 解:A、二氧化氮不属于酸性氧化物,SO2和CO2都属于酸性氧化物,故A错误;
B、甲烷和属于烷烃,但是一氯甲烷中含有氯元素,不属于烷烃,属于卤代烃,故B错误;
C.碱性氧化物是和酸反应生成盐和水的氧化物,碱性氧化物都是金属氧化物,故C正确;
D、只有在水溶液中能电离出的阳离子全部是H+的化合物才属于酸,如硫酸氢钠在水溶液中能电离出氢离子,但是属于盐,故D错误.
故选C.
点评 本题考查学生物质分类的有关知识,注意知识的归纳和整理是关键,概念的掌握要灵活,难度中等.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 甲学生用50mL量筒量取46.70mL浓盐酸 | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生配NaOH溶液,用电子天平称取固体1.220g | |
| D. | 丁学生用红柄滴定管量取25.00mL0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
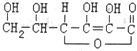 ,有关它的叙述不正确的是( )
,有关它的叙述不正确的是( )| A. | 在碱性溶液中能稳定存在 | |
| B. | 容易发生氧化反应和加成反应 | |
| C. | 可以溶解于水,溶液显酸性 | |
| D. | 可以看作环状酯类化合物,分子式为C6H8O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 对于pH相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的pH相等,则m>n | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
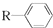 $→_{一定条件}^{CO、HCl}$
$→_{一定条件}^{CO、HCl}$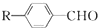 ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: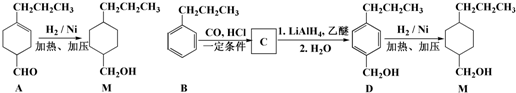
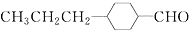 和
和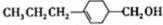 (写结构简式)生成.
(写结构简式)生成.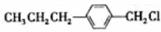 .
.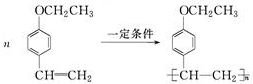 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com