
| A、加入过氧化钠后的溶液中:Na+、K+、Cl-、SO32- |
| B、含大量Fe3+的溶液中:Mg2+、Cl-、SO42-、NO3- |
| C、与Al反应放出H2的溶液中:NH4+、Na+、SO42-、F- |
| D、无色透明溶液中:Al3+、Ca2+、I-、HCO3- |


科目:高中化学 来源: 题型:
| A、SiO2→H2SiO3 |
| B、Cu(OH)2→Fe(OH)2 |
| C、CaCO3→Na2CO3 |
| D、Cu→Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、海水
| ||||||
B、海水
| ||||||
C、海水
| ||||||
D、海水
|
查看答案和解析>>
科目:高中化学 来源: 题型:
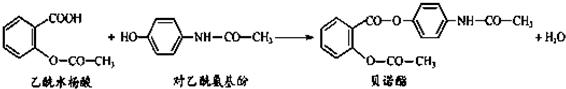
| A、贝诺酯分子中有三种含氧官能团 |
| B、对乙酰氨基酚核磁共振氢谱中共有四个峰 |
| C、乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应 |
| D、贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠是银白色金属,硬度很大 |
| B、金属钠在空气中燃烧,生成氧化钠 |
| C、金属钠的熔点很高 |
| D、加热时,金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的溶液中:MnO4-、SO42-、K+、Fe2+ |
| B、c(OH-)/c(H+)=1012的水溶液中:K+、ClO-、S2-、Cl- |
| C、水电离出的c(H+)=10-12mol/L中:K+、AlO2-、CH3COO-、CO32- |
| D、能使加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃时2.7mL 水 |
| B、2.24L一氧化碳(标准状况下) |
| C、6.02×1022个氯化氢分子 |
| D、4.9g 磷酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体带电荷,而溶液呈电中性 |
| B、胶体区别与其他分散系的本质特征是分散质粒子的大小 |
| C、某元素从化合态变为游离态时,该元素一定被还原 |
| D、醋酸、纯碱、石灰石、氨水分别属于酸、碱、盐和电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com