
| A、1:2 | B、2:1 |
| C、1:1 | D、3:1 |
科目:高中化学 来源: 题型:
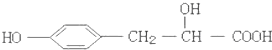 某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )
某有机物的结构简式如图,它可能发生的反应类型有:①取代反应;②加成反应;③消去反应;④水解反应;⑤酯化反应;⑥中和反应;⑦氧化反应;⑧加聚反应.( )| A、①②③④⑥ |
| B、②③④⑥⑧ |
| C、①②③⑤⑥⑦ |
| D、③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SiO32-、Cl-、NO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、Na+、S2-、OH-、SO42- |
| D、Na+、C6H5O-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、加入0.1mol/L 的醋酸溶液100mL |
| C、加入少量的0.5mol/L的硫酸 |
| D、加入少量1mol/L 的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔现象可用来区别胶体与溶液 |
| B、胶体粒子能通过半透膜,不能通过滤纸 |
| C、胶体不稳定,在一定条件下会发生聚沉 |
| D、溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有 NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、在常温常压下,64g SO2中含有的原子数为3NA |
| C、25℃,1.01×105Pa,11.2L Cl2含有的分子数为0.5NA |
| D、在标准状况下,11.2L H2O含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com