
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ1�� 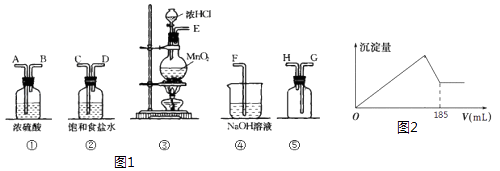
��1������������������ȷ˳������ӿڴ�����ĸ������E�������������� ��
��2��װ���У�Ũ�������������NaOH��Һ�������� ��
��3����ѧʵ���г���ʪ��ĵ��۩�KI��ֽ�����Ƿ���Cl2�����������Cl2�������ɹ۲쵽
��4��д�����л�ѧ��Ӧ�ķ���ʽ�� �����巢��װ���н��еķ�Ӧ��
��NaOH��Һ�з�����Ӧ�����ӷ���ʽ��
������0.05mol Al3+��Fe3+����Һ�е���1mol/L NaOH��Һ�����ɳ������������NaOH��Һ�������ϵ��ͼ2��ʾ������Һ��Al3+���ʵ���Ϊ ��
���𰸡�
��1��C�� D�� A�� B�� G�� H�� F
��2����ȥ�����е�H2O��g�������չ���������
��3����ֽ����
��4��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��2OH��+Cl2=Cl��+ClO��+H2O��0.035mol
MnCl2+Cl2��+2H2O��2OH��+Cl2=Cl��+ClO��+H2O��0.035mol
���������⣺��1����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿������������Ҫ����װ�������������ñ���ʳ��ˮ��ȥ�Ȼ��⣬ͨ��Ũ�����ȥˮ�����������ܳ����̴��ռ����������������������Һ���ն����������װ������˳���ǣ�E��C��D��A��B��G��H��F��
��Ϊ��C D A B G H F����2��Ũ����������dz�ȥ�����е��Ȼ������壻NaOH�����������չ�������������ֹ��Ⱦ������
���Դ��ǣ���ȥ�����е�H2O��g�������չ�����������3���ٷ���װ�����Ƕ������̺�Ũ������ȷ�Ӧ�����Ȼ��̡�������ˮ����Ӧ����ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
�������ж�������������Һ���գ��������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪ��Cl2+2OH��=Cl��+ClO��+H2O��
���Դ��ǣ�Cl2+2OH��=Cl��+ClO��+H2O��
����ͼ���֪����������ȫ����ʱ����185mL�������ƣ�������0.185molNaOH���躬��xmolAl3+��ymolFe3+���漰���ӷ���ʽΪ
Fe3++ | 3OH��=Fe��OH��3�� | Al3++ | 4OH��=AlO2��+2H2�� |
y | 3y | x | 4x |
�� x+y=0.05��
4x+3y=0.185��
�����������֮��x=0.035 y=0.015 ���Դ��ǣ�0.035mol
�����㾫��������������ʵ�����Ʒ��ǽ����ĸ�������Ҫ֪��ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭWO3�Ʊ�����W��װ����ͼ��ʾ��Zn������������̼�����ʣ�����ûʳ������Һ������������������������˵����ȷ���ǣ�������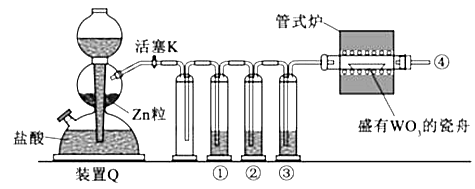
A.�١��ڡ���������ʢװKMNO4��Һ��ŨH2SO4������ûʳ������Һ
B.��ʽ¯����ǰ�����Թ��ڢܴ��ռ����岢��ȼ��ͨ�������ж�����Ũ��
C.������Ӧʱ���ȹرջ���K����ֹͣ����
D.װ��Q�����շ�������Ҳ�����ڶ���������Ũ���ᷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ������ص��ǣ� ��
A. NH3���Ӽ�������ˮB. ˮ��ɱ�������ͣ��ܶȱ�С
C. ˮ���ȵ��ܸߵ��¶ȶ����Էֽ�D. ˮ�ķе��H2S�ķе��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������»��������˵����ȷ���ǣ� �� 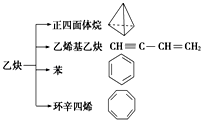
A.����������ķ���ʽΪC4H4 �� ����ȴ���������
B.����������Ȳ����ϩ����Ȳ��ȫȼ��ʱ�ĺ�������ͬ
C.��Ϊƽ�������νṹ�������д���C��C��C�TC����ʹ����KMnO4��Һ��ɫ
D.������ϩ�����Ľṹ������ʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�Ļ���ԭ�ϣ���;�㷺��
��1���ϳɰ��������ô��������ͭ����[Cu��NH3��2]+��CH3COO�����ɣ���Һ���ն��ϳɴ����ж�����CO���壮
�ٴ��������ͭ������Ԫ���У���һ������������ ��
�ڴ��������ͭ����Ԫ�صĵ��ʣ������ľ���������������ţ���
a�����Ӿ��� b�����Ӿ��� c��ԭ�Ӿ��� d����������
�۵�4�����У���̬ԭ�����̬Cuԭ��δ�ɶԵ�����Ŀ��ͬ��Ԫ�����֣�����Cu����
��ͭ����Ϊ�����������壬�侧���߳�a nm����ʽ��ʾͭ���ʵ��ܶ� gcm��3 ��
��2��BF3������NH3������������һ�ְ�ɫ���壺BF3+NH3=F3B��NH3 ��
�پ���F3B��NH3�У�Bԭ�ӵ��ӻ��������Ϊ ��
��д��������BF3������ͬ�ռ乹�͵��������� ��
��3��NH3�����ںϳ����ء�����淋ȵ��ʣ�ij���ʳ���������������м��һ�����ΪN4H4��SO4��2�����ʣ���������ˮ��Һ����SO42����N4H44+�����������幹�͵����Ӵ��ڣ�N4H44+��������һ�����ư���N4���ӣ�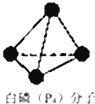
���������˵���У���ȷ����������ţ���
a��N4��N2��ͬ���칹��
b��1mol N4�ֽ�����N2 �� �γ���4mol �м�
c�����ķе��N4�ߣ�����ΪP��P�����ܱ�N��N����
d�����Ļ�ѧ���ʱ�N2���ã�˵��P�ķǽ����Ա�Nǿ
�ڻ���N4H44+�Ľṹ���������е���λ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ����ķ��뷽����˵������ȷ����(����)
A. �е㲻ͬ��Һ̬����������������
B. �������ܵ�Һ̬�������÷�Һ��������
C. ���ܵ�Һ̬�������÷�Һ�ķ�������
D. ������ˮ�Ĺ�����������ˮ�Ĺ����γɵĻ��������ܽ⡢���ˡ������ķ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ����һ�ֳ��õ�ʳƷ���Ӽ��������㡢����ʳ�����պ�����ӳ������ڣ�����Ϊ (����)
A.NaCl�е�Cl����ɱ������
B.Ũʳ��ˮ�к�O2�٣�ϸ��������
C.����������ʹϸ��ʧˮ����
D.����������ʹ�㡢��ϸ��ʧˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƿ������ڸ��Ƶر�ˮ�ʣ��������ؽ������ӷ�ˮ�������ೱ��Ҳ������Ӧ�������ȣ���ҵ�������������Ƶ���Ҫ�������£� 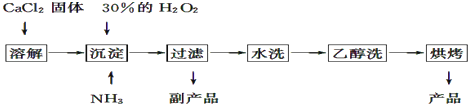
��֪CaO28H2O�ʰ�ɫ������ˮ�������ڴ�������ѵȣ�������350�����ҿ�ʼ�ֽ�ų�������
��1��������������ȡCaO28H2O�Ļ�ѧ����ʽ����
��2�����Ʒ��ĸ���ƷΪ���ѧʽ����Ϊ����߸���Ʒ�IJ��ʣ��ᾧǰҪ����Һ��pH���������ʷ�Χ���ɼ�����Լ�����
��3�����顰ˮϴ���Ƿ�ϸ�ķ�������
��4���ⶨ��Ʒ��CaO2�ĺ�����ʵ�鲽�裺
��һ����ȷ��ȡa g��Ʒ��������ƿ�У�������������ˮ������b g KI���壬�ٵ�������2molL��1��������Һ����ַ�Ӧ��
�ڶ�������������ƿ�м��뼸�ε�����Һ��
����������μ���Ũ��Ϊc molL��1��Na2S2O3��Һ����Ӧ��ȫ������Na2S2O3��ҺV mL��
��֪��I2+2S2O32���T2I��+S4O62��
�ٵ�һ����Ӧ�����ӷ���ʽΪ��
�ڵ�������ʢ��Na2S2O3��Һ������������ �� ��Ӧ��ȫʱ������Ϊ
�۲�Ʒ��CaO2����������Ϊ������ĸ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳƷ��ȫ�ѳ�Ϊ������������ע���ȵ�����֮һ�������й�ʳƷ���Ӽ�ʹ�õ�˵����ȷ����(����)
A.Ϊ�˵���ʳƷɫ��,����ʳƷ���,ʹ�ù�ҵɫ���յ���
B.Ϊ������̷��е�����,���������������谷
C.Ϊ�˷�ֹʳƷ����,�����������������Դﵽ����ϸ����ֳ������
D.ʳ������ζ��,��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com