
某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分.
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示.
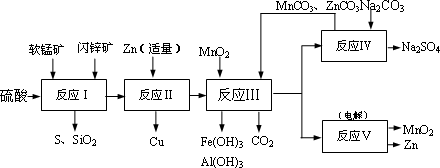
请回答下列问题:
(1)
反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等.试完成反应Ⅰ中生成CuSO4和MnSO4的化学方程式:MnO2+CuS+________=________↓+________+CuSO4+________
.(2)反应Ⅱ加入适量锌的作用是________;如果锌过量,还会进一步发生反应的离子方程式为________.
(3)反应Ⅲ要调节pH生成Fe(OH)3、Al(OH)3,中过量的H+所使用的物质是________,调节的pH范围是________(pH数据见下表).
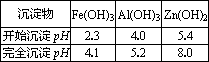
(4)本工艺可以循环利用的物质有ZnCO3、、MnCO3和________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各约占2%。
MnO2和Zn是制造干电池的原料。电解法生产MnO2传统的工艺主要流程为:软锰矿加焦炭还原熔烧,用H2SO4浸出熔烧料,浸出液经净化然后电解,在阳极上析出MnO2。
电解制锌的传统工艺为:闪锌矿高温氧化脱硫再还原得粗锌。

将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
90年代生产MnO2和Zn的新工艺是通过电解获得MnO2和Zn。
![]()
![]()
试回答下列问题。
(1)已知在第①步中发生了反应:
MnO2+ZnS+2H2SO4====MnSO4+ZnSO4+S+2H2O
据此写出第①步反应中MnO2和CuS与酸反应的离子方程式:__________,软锰矿中Al2O3溶于酸的离子方程式:______________________________。
(2)产品C为____________,当第③步电解时,电路中通过1 mol电子时,阳极生成__________,其物质的量为__________。
(3)试从环境保护和能量消耗的角度,评价90年代新工艺与传统工艺相比较有哪些优点。
____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O22ZnO+2SO2 2C+O2
2CO ZnO+CO
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省启东中学高一第二学期期中考试化学(实验班)试题 题型:填空题
(10分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O2 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 2CO ZnO+CO
2CO ZnO+CO Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:
试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高一第二学期期中考试化学(实验班)试题 题型:填空题
(10分)MnO2和锌是制造干电池的主要原料。某地有软锰矿和闪锌矿两座矿山,它们的主要成份为:
软锰矿:MnO2含量≥65% Al2O3含量为4%
闪锌矿:ZnS含量≥80% FeS、 CuS、 CdS含量各为2%
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液经净化后再进行电解,MnO2在电解池的阳极析出。
电解锌的传统生产工艺为:闪锌矿高温氧化脱硫再用热还原法还原得粗锌:
2ZnS+O2 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 2CO ZnO+CO
2CO ZnO+CO Zn(g)+CO2
Zn(g)+CO2
将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
现在生产MnO2和锌的新工艺主要是通过电解获得MnO2和锌,副产品是硫、金属铜和镉。简化流程杠图如下:

试回答下列问题:
(1)Zn的原子序数为30,它在元素周期表中的位置是 ;软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,据此写出MnO2在酸性溶液中分别FeS发生氧化-还原反应的化学方程式 ;软锰矿中Al2O3溶于硫酸的离子方程式 ;由滤渣甲回收硫黄的实验方法是 ;
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程 ______________________________________________________________________。
(3)滤渣丙的化学成分是 ;
(4)用铁和铂电极电解MnSO4和ZnSO4的混合溶液可以得到Zn和MnO2,电解时,铁做 极,铁极发生的电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com