
【题目】走进化学变化的微观世界,有利于进一步认识化学变化。下图是某化学变化的微观示意图,X、Y、Z分别表示不同类别的原子,据图回答问题:

反应前 反应后
(1)该化学反应中生成物的分子个数比为______________;
(2)从微观角度分析,化学反应前后各物质的质量总和相等的原因是__________________________________________________________;
(3)该化学反应的基本类型为_________________________________;
(4)由X原子构成的物质在该反应中____________(填“是”或“不是”)催化剂。
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。请回答下列问题:

(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点______(填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响且理由是_______。
(3)图中A表示SO2(g)和O2(g) 的_________。图中△H的意义是__________。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式__________;V2O5对该反应进行的程度有无影响 _____________
(5)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只含SiO2杂质的石灰石样品,在高温下熔烧得到的残留物经检验为一纯净物,则原样品中SiO2的质量分数为( )
A. 28.5% B. 37.5% C. 40% D. 62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷元素是组成遗传物质核酸的基本成分之一,而锡元素(Sn)形成的某些化合物能够促进核酸的合成。回答下列问题。
(1)基态磷原子电子占据的最高能层符号是____,占据该能层的电子中能量最高的电子其电子云在空间有_____个伸展方向,原子轨道呈_____形。
(2)锡元素可形成白锡、灰锡、脆锡三种单质。研究灰锡晶体的结构最常用的仪器是_____。灰锡晶体与金刚石结构相同,但灰锡不稳定,其原因是_____。
(3)固态PCl5结构中存在PCl4+和PCl6-两种结构单元,其晶胞如图所示。
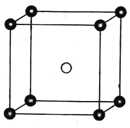
①PCl4+的空间结构为________,PCl3的键角小于PCl4+键角的原因为___________。
②已知晶胞的边长为anm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______pm,固态PCl5的密度为______g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废Ni--MH电池正极材料可制备电子级硫酸镍晶体,其工艺流程如下图所示:
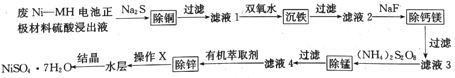
回答下列问题:
(1)废Ni-NH电池正极材料硫酸浸出液中的成分浓度如下表所示:
成分 | Ni2+ | Fe2+ | Cu2+ | Ca2+ | Mg2+ | Mn2+ | H+ | SO42- |
浓度(mol/L) | c | 0.013 | 0.0007 | 0.0013 | 0.0030 | 0.004 | 0.01 | 1.8 |
溶液中c(Ni2+)=_____mol/L(结果保留四位有效数字)。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:___________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+):c(Ca2+)=0.67,则MgF2的溶度积为______[已知Ksp(CaF2)=1.10×10-10]。
(4)“除锰”时,(NH4)2S2O8与“滤液3”中的MnSO4反应生成含锰化合物R、硫酸铵及硫酸,若氧化剂与还原剂物质的量之比为1:1,则R的化学式为_____。(填字母)
a.MnO2 b.Mn2O3 c.(NH4)2MnO4 d.Mn(OH)3
(5)“除锌”时,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。
①试写出萃取时反应的离子方程式______________。
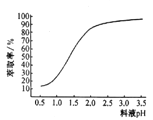
②“除锌”时、锌的萃取率随料液pH变化如右图所示:试分析pH增大时,锌的萃取率有所增大的原因是_____________________。
③“操作X”的名称是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案,请完成有关问题。
方案Ⅰ:将形状和大小均相同的铁片和铜片,分别同时放入100 mL 2.0 mol·L-1稀硫酸中,观察反应的情况,据此确定它们的金属活动性。
方案Ⅱ:利用Fe、Cu作电极设计成原电池,以确定它们的金属活动性。
(1)方案Ⅰ中发生反应的离子方程式为 。
(2)在方框内画出方案Ⅱ中的原电池装置图,注明电解质溶液名称和正、负极材料,标出电子流动方向,并写出电极反应式:
正极: ;
负极: 。
(3)结合你所学的知识,请你再设计一个与方案Ⅰ、Ⅱ不同的验证Fe、Cu活动性的简单实验方案: ,用离子方程式表示其反应原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
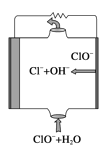
A.放电过程中OH-移向正极
B.电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-
C.镁电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。制备装置如下图所示:(其中Ⅲ、Ⅳ、Ⅴ中都为浓硫酸)
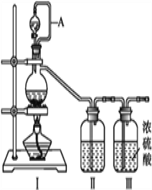

(1)用同一装置Ⅰ、Ⅱ、III分别制备纯净干燥的NO和Cl2,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | 浓盐酸 | ①___ |
制备纯净NO | Cu | ②___ | 水 |
(2)A的作用____________________________。
(3)NOCl的电子式_________。
(4)利用制得的NO和Cl2制备NOCl,方程式:2NO + Cl2 = 2NOCl;装置如上图所示:
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅷ中吸收尾气时,Cl2发生反应的离子方程式为________________。
(5)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气,该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
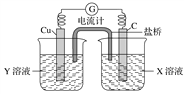
(1)写出电极反应式:正极___________________;负极_________________。
(2)图中X溶液是____________,Y溶液是____________。
(3)原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。
(4)X溶液中石墨电极上发生____________(填“氧化”或“还原”)反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com