
| A.KClO3溶液 | B.熔融的NaCl | C.KCl晶体 | D.氯化氢气体 |
科目:高中化学 来源:不详 题型:单选题
| A.在pH=13的溶液中:Na+、Ba2+、Cl-、NO3- |
| B.使石蕊试液变红的溶液:Na+、ClO-、Cl-、NO3- |
| C.无色溶液:Cu2+、K+、SO42-、Cl- |
| D.强碱性溶液:K+、Mg2+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+一定存在 |
| B.100 mL溶液中含0.01 mol CO32— |
| C.Cl-可能存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+ NO3- CO32- Na+ |
| B.Na+Ba2+Mg2+HCO3- |
| C.NO3- K+AlO2- OH- |
| D.NO3- Ca2+K+Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 |
| B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
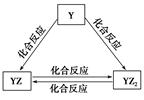
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
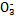 >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2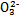
 S4
S4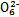 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1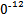 )。
)。| 实验步骤 | 实验过程和现象 | 对应结论 | |
| 步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 | _____________ | |
| 步 骤 2 | 第①份 试液 | 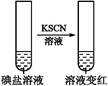 | 碘盐中肯定含 |
| 第②份 试液 | 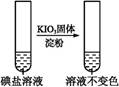 | _____________ | |
| 第③份 试液 | 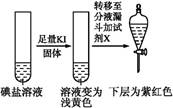 | X为 (填化学式) | |
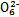 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
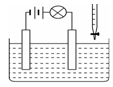
| A.氢氧化钡溶液中逐滴加入硫酸 |
| B.氢氧化钠溶液中逐滴加入硫酸 |
| C.石灰乳中逐滴加入稀盐酸 |
| D.食盐溶液中逐滴加入盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com