
| A. | 用水可区分苯和溴苯 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| D. | 用金属钠可区分乙醇和乙醚 |
分析 A.苯、溴苯均不溶于水,苯的密度比水小,溴苯密度比水大;
B.3-己烯能被高锰酸钾氧化,己烷不能;
C.甲酸甲酯和乙醛均含-CHO;
D.乙醇与Na反应生成氢气,而乙醚与Na不反应.
解答 解:A.苯、溴苯均不溶于水,苯的密度比水小,溴苯密度比水大,则与水分层现象不同,水可鉴别,故A正确;
B.3-己烯能被高锰酸钾氧化,己烷不能,则高锰酸钾溶液能区分,故B正确;
C.甲酸甲酯和乙醛均含-CHO,均与银氨溶液发生银镜反应,现象相同不能鉴别,故C错误;
D.乙醇与Na反应生成氢气,而乙醚与Na不反应,现象不同,可利用Na区分,故D正确;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意有机物的性质应用,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 | 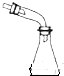 | 饱和NaHSO3溶液 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

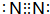 ;⑨的过氧化物
;⑨的过氧化物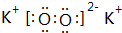 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
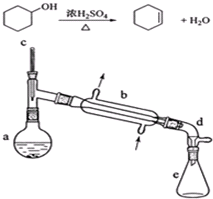
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
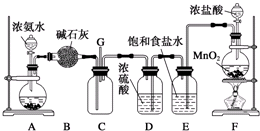
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4gCu在足量的硫蒸气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LSO2和SO3的混合物中硫原子数为0.5NA | |
| C. | 1L0.1mol•L-1的NH4Cl溶液中NH4+数目为0.1NA | |
| D. | 通常情况下,3.4gNH3中共用电子对数为0.8NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com