
(14分)X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)_________________________。
(2)QX的电子式为___________;QX与水反应放出气体的化学方程式为____________。
(3)X、Z两元素能形成两种化合物的电子式分别为 和 。
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系
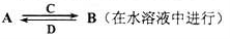
①其中C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式__________________;
②如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式 __。
(每空2分 共14分)
(1)Na>Al>C>O>H
(2)Na+[:H]- NaH + H2O = NaOH + H2↑
(3)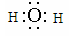
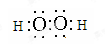
(4)O=C=O; AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
【解析】
试题分析:X、Y两元素最高正价与最低负价之和均为0,则X是第IA族、Y是第IVA族元素,X是H元素,Y是C元素;Q与X同主族,则Q是Na元素;Z、R分别是地壳中含量最高的非金属元素和金属元素,则地壳中含量最高的非金属是O元素,金属元素是Al元素,所以Z是O元素,R是Al元素;
(1)根据原子半径随电子层数的增多而增大,随核电荷数的增多而减小,所以5种元素的原子半径的大小关系是Na>Al>C>O>H;
(2)NaH是离子化合物,其电子式为Na+[:H]-;NaH与水反应生成氢氧化钠和氢气,化学方程式是NaH + H2O = NaOH + H2↑;
(3)H与O形成的两种化合物为水和过氧化氢,都是共价化合物,所以电子式分别是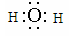 、
、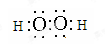 ;
;
(4)在5种元素中,溶于水显酸性的气体只能是二氧化碳,其结构式为O=C=O;
如果A、B均由三种元素组成,B为两性不溶物,则B是氢氧化铝,因为D是淡黄色固体,则D是过氧化钠,与氢氧化铝、水反应,生成偏铝酸钠,则A是偏铝酸钠,所以A转化为B的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;或生成碳酸根离子,离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-。
考点:考查元素的推断,化学用语的书写,物质性质的应用


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2014-2015湖南省娄底市高一上学期期末考试化学试卷(解析版) 题型:选择题
将铜粉放入稀硫酸中,加热无明显变化,但加入某盐后发现铜粉质量明显减少,则该盐不可能是
A.Fe2(SO4)3 B.NaCl C.KNO3 D.Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省娄底市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
在298 K、100 kPa时,已知:
Cl2(g)+H2(g)===2HCl(g) ΔH1 2H2O(g)===2H2(g)+O2(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH2和ΔH1之间的关系正确的是
A.ΔH3=2ΔH1-ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=2ΔH1+ΔH2 D.ΔH3=ΔH2-ΔH1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省茂名市高三一模考试理综化学试卷(解析版) 题型:填空题
(16分)对乙烯基苯甲酸是重要的医药中间体,广泛应用于合成感光材料。对乙烯基苯甲酸可通过如下反应合成。

(1)下列关于化合物I和化合物II的说法,正确的是______。
A.化合物I能与新制的Cu(OH)2反应
B.均可发生酯化反应和银镜反应
C.化合物II能使KMnO4溶液褪色
D.1mol化合物II最多能与5 mol H2反应
(2)化合物II的分子式为____________,化合物II在催化剂条件下生产高分子化合物的反应方程式 。
(3)化合物II可由芳香族化合物Ⅲ通过消去反应获得,Ⅲ和Cu共热的产物能发生银镜反应,写出化合物Ⅲ的结构简式 ;
(4)化合物IV是化合物II的同分异构体,且化合物IV遇FeCl3溶液显紫色,苯环上的一氯代物只有2种,写出化合物IV的结构简式 (写一种)。
(5)利用类似反应①的方法,仅以溴苯(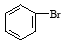 )和乳酸(
)和乳酸( )为有机物原料合成化工原料肉桂酸(
)为有机物原料合成化工原料肉桂酸(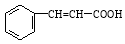 ),涉及的反应方程式为 。
),涉及的反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省茂名市高三一模考试理综化学试卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是
A.Ag+、Ca2+、Cl-、Br- B.I-、H+、SO42-、 ClO-
C.Al3+、NH4+、Cl-、CO32- D.K+、Mg2+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是:
A.将过量SO2气体通入氨水中:SO2+2 NH3·H2O =2 NH4+ + SO32-+H2O
B.向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3- = BaCO3↓+2H2O+ CO32-
D.硝酸铁溶液中滴加足量HI溶液:Fe3+ + 3NO3-+12H+ +10I- = Fe2+ + 5I2 + 3NO↑ + 6H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是:
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.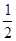 H2SO4(aq)+
H2SO4(aq)+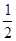 Ba(OH)2(aq)===
Ba(OH)2(aq)===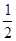 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:实验题
(14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:

提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是_____,加入Sn粉的作用是____。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式_______________。
(3)检验沉淀已经“漂洗”干净的方法__________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0molL-1,则应控制溶液pH______。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-
离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中一定不正确的是
A.它们的原子序数A>B>C B.它们的离子半径A2->C->B2+
C.它们的原子半径C>B>A D. 它们的最外层电子数C>A>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com