
【题目】已知:P4(g)+6Cl2(g)![]() 4PCl3(g) ΔH=a kJ·mol1,
4PCl3(g) ΔH=a kJ·mol1,
P4(g)+10Cl2(g)![]() 4PCl5(g) ΔH =b kJ·mol1,
4PCl5(g) ΔH =b kJ·mol1,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol1,PCl3中P—Cl键的键能为1.2c kJ·mol1。下列叙述正确的是
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)![]() PCl5(s)的反应热ΔH
PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为(ba+5.6c)/4 kJ·mol1
D.P—P键的键能为(5a3b+12c)/8 kJ·mol1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】回答问题。
(1)用双线桥法标明电子转移的方向和数目。
①2Al+Fe2O3![]() 2Fe+Al2O3:________;
2Fe+Al2O3:________;
②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O:________;
MnCl2+Cl2↑+2H2O:________;
(2)在②中氧化剂是________ ,还原剂是_________,被氧化的元素是_____,被还原的元素是______,氧化剂与还原剂之比是___________,当有71gCl2生成时,被氧化的HCl的物质的量是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。

已知:I. (R或R可以是烃基或H原子)。
(R或R可以是烃基或H原子)。
II.反应①、反应②、反应⑤的原子利用率均为100%。
请回答下列问题:
(1)B的名称为______,X中的含氧官能团名称为________,反应③的条件为_____,反应④ 的反应类型是__________。
(2)关于药物Y ( )的说法正确的是(____)
)的说法正确的是(____)
A.药物Y的分子式为C8H8O4,遇氯化铁溶液可以发生显色反应
B. lmol药物Y与H2、浓溴水中的Br2反应,最多消耗H2、Br2分别为4 mol和2 mol
C. lmol 药物Y与足量的钠反应可以生成22.4L氢气
D.药物Y中⑥、⑦、⑧三处-OH的电离程度由大到小的顺序是⑧>⑥>⑦
(3)写出反应E→F的化学方程式__________。
(4)写出符合下列条件的E的所有同分异构体的结构简式_________。
① 属于酚类化合物,且是苯的对位二元取代物;② 能发生银镜反应和水解反应。
(5)设计一条以CH3CHO及CH3OH 为起始原料合成Z的线路(无机试剂及溶剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个甲醚燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)写出负极的电极反应式_____________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”、“ 减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为______。假设乙装置中氯化钠溶液足够多,若在标准状况下,有224mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将____________(填“增大”、“减小”或“不变”),且变化了_______克。
(5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学探究学习小组的同学用下图所示装置制取氯气并探究氯气的某些性质。
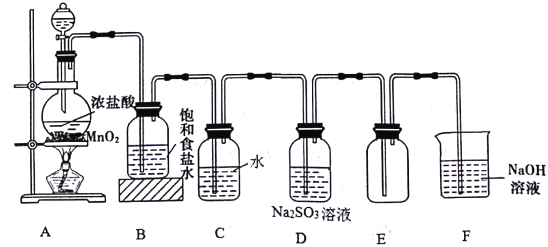
(1)装置A中制取Cl2的化学方程式为________________________。
(2)装置C中发生反应的离子方程式为_________________,反应后溶液中含Cl元素的分子有_________。
(3)实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 _____________ 。
(4)装置F的作用是______,该装置中发生反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为前三周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
(1)当n = 2时.AB2属于____分子(填“极性”或“非极性”) ,分子中有____个σ键、___个π键。A6H6分子中A原子的杂化轨道类型是______杂化。
(2)当n = 3时,A与B形成的晶体属于______晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(4)己知某红紫色配合物的组成为CoCl3 ·5NH3· H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为_______。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
(1)H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为______ 元酸,其电离方程式是__________.
(2)H3PO2是中强酸,写出其与NaHCO3溶液反应的离子方程式______________________.
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则其氧化产物为_____________;(填化学式)
(4)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质及非电解质的组合完全正确的是( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
弱电解质 | HF | BaSO4 | HClO | CH3COOH |
非电解质 | Cl2 | CO2 | H2S | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]__________,有 ______个未成对电子。
(2)镓氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是 ___________。
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为 _____mol。AS4O6含有![]() 键的物质的量为_________mol。
键的物质的量为_________mol。

(4)As与N是同主族兀素,AsH3的沸点(-62.5 ℃)比NH3的沸点(-33.5℃)低,原因是______。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比
H3ASO3强的原因是_________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,![]() );B处As为(
);B处As为(![]() ,
,![]() ,
,![]() );C处Li的坐标参数为__________。
);C处Li的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数a = 594 pm,NA表示阿伏加德罗常数的数值,其密度为 ____g cm3 (列出计算式即可)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com