
铝硅合金材料性能优良。铝土矿(含 30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:
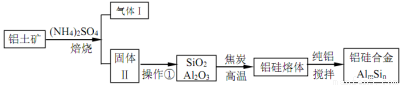
(1)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是______________。
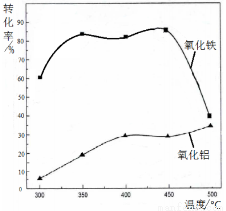
(2)焙烧除铁反应时 Fe2O3 转化为NH4Fe(SO4)2,Al2O3少部分发生类似反应。写出 Fe2O3发生反应的方程式:______________。 氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______________。
(3)若操作①中所得溶液中加入过量NaOH 溶液,含铝微粒发生反应的离子方程式为:______________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体 SiC 再与Al2O3反应生成铝、硅单质的化学方程式并表出电子转移的方向和数目:______________ 。
(5)已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向 FeCl3和 AlCl3的混合溶液中逐滴加入NaOH 溶液,生成 Al(OH)3和Fe(OH)3沉淀,当两种沉淀共存时,上层溶液中 c(Al3+):c(Fe3+)=__________________。
科目:高中化学 来源:2015-2016学年浙江省高二下十一次联考化学试卷(解析版) 题型:选择题
下列有关化学用语使用正确的是( )
 A.乙烯的结构简式:CH2CH2
A.乙烯的结构简式:CH2CH2
B.对氯甲苯的结构简式: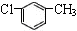
C.CH2ClCH2Cl的名称:二氯乙烷
D.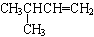 的名称:3-甲基-1-丁烯
的名称:3-甲基-1-丁烯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:填空题
工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
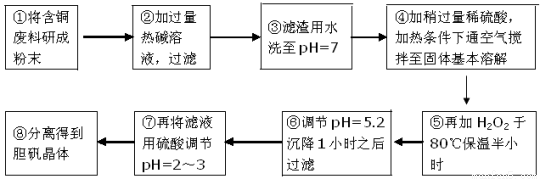
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
请回答下列问题:
(1)步骤①中为什么要将含铜废料研磨成粉状? 。
(2)步骤②中的离子方程式(写出2个即可):
、
。
(3)步骤⑤中H2O2参加反应的离子方程式: 。
(4)步骤⑥中调节溶液pH时适宜的物质是 (填序号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是 。
(6)步骤⑧的分离方法步骤是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
下列叙述I和叙述II均正确且有因果关系的是( )
选项 | 叙述I | 叙述II |
A | H2有还原性,浓硫酸有强氧化性 | 不能用浓硫酸干燥H2 |
B | CuS难溶于水和硫酸 | 反应:H2S+CuSO4=CuS↓+H2SO4 可以发生 |
C | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
D | SO2具有酸性和漂白性 | 往紫色石蕊溶液中通入SO2,溶液先变红再褪色 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
下列现象与氢键有关的是( )
①HF的熔、沸点比第ⅦA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的溶、沸点比醋酸的高
⑤邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的低
⑥水分子在较高温度下也很稳定
A.①②③④⑤⑥ B.仅①②③④⑤
C.仅①②③④ D.仅①②③
查看答案和解析>>
科目:高中化学 来源:2017届四川省新高三零诊模拟理综化学试卷(解析版) 题型:填空题
2015年“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。NaCN属于剧毒物质,若处理不当,极易污染土壤和海水。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是______________。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下受热分解,可发生不同的化学反应:
在110℃时:NH4NO3=NH3+HNO3
在185~200℃时:NH4NO3=N2O+2H2O
在230℃ 以上时,同时有弱光:2NH4NO3=2N2+O2+4H2O
在400℃ 以上时,发生爆炸:4NH4NO3=3N2+2NO2+8H2O
上述反应过程中一定破坏了______________。(填“离子键”或“共价键”或“离子键和共价键”)
(3)NaCN 的电子式为______________。下列能说明碳与氮两元素非金属性相对强弱的是______________。
A.酸性:HNO2>H2CO3
B.相同条件下水溶液的 pH:NaHCO3>NaNO3
C.CH4比NH3更稳定
D.C 与H2的化合比N2与H2的化合更容易
(4)海水中含有Ca2+、Mg2+、HCO3- 等杂质离子。用惰性电极电解海水时阴极易产生水垢,其主要成分是 Mg(OH)2和CaCO3。写出电解海水的离子方程式______________;生成CaCO3的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源:2017届四川省新高三零诊模拟理综化学试卷(解析版) 题型:选择题
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
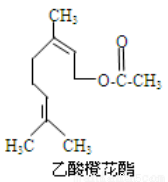
A.分子式为C12H22O2
B.能使酸性KMnO4溶液褪色,能发生加成反应,但不能发生取代反应
C.1mol该有机物水解时只能消耗 1 mol NaOH
D.1mol该有机物在一定条件下和H2反应,共消耗 H2为3mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二实验班下期中化学卷(解析版) 题型:推断题
有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料。D与A位于同一主族,是构成地球上矿物质的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是 ;再向上述溶液中加入乙醇,有 ;原因是 ;
(4)A的氢化物比D的氢化物相比,熔点高是的 (填化学式),理由是
(5)下列说法正确的是( )
a.晶体析出规则是晶格能高的晶体最后析出
b.铜型和钾型都是密置层堆积方式
c.在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高
(6)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为_____________,已知两个最近的Ca原子之间的距离为apm,则该合金的密度为_____________g/cm3,(用含NA和a的代数式表示)。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.100mL、pH=3的HA和HB分别与足量的锌充分反应,HA放出的氢气多,说明HA的酸性比HB弱
B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
C.在NH4HSO4溶液中由于NH4+的水解促进了水的电离,所以水的电离程度增大
D.在一密闭容器中发生2SO2+O2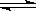 2SO3反应,增大压强,平衡会正向移动,
2SO3反应,增大压强,平衡会正向移动,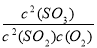 的值增大
的值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com