
| A. | 铝热剂 | B. | 生铁 | C. | 绿矾 | D. | 钢 |
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:填空题
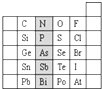 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.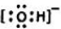 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
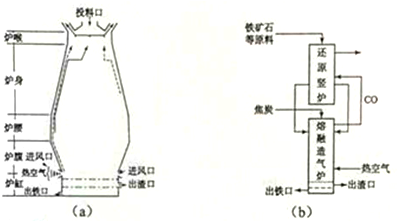
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中加入铝粉来制备H2:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 实验室用氢氧化钠溶液吸收Cl2:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 用胃舒平治疗胃酸过多:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑤ | C. | ②④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Ca原子半径从大到小 | B. | O2-、Na+、K+半径从小到大 | ||
| C. | Cl、Cl- 半径前者大 | D. | H、N、Al 半径从小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
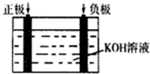
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,PH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 | |
| D. | 人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代,目前,全球已主要处于多能源时代 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com