
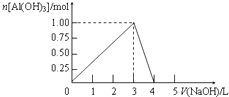
 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )| A. | 反应过程中,沉淀最多时的质量为7.8g | |
| B. | AlCl3溶液的浓度为2.0 mol•L-1 | |
| C. | 得到39g沉淀时,消耗的NaOH溶液体积为1.5L或3.5L | |
| D. | 当V(NaOH)=4L时,得到的溶液中Na+、Cl-浓度相等 |
分析 A.由图可知,沉淀最多为1.00mol,根据m=nM计算;
B.根据Al元素守恒计算氯化铝物质的量,再根据c=$\frac{n}{V}$计算;
C.得到39g沉淀时,即为0.5mol,由图可知存在两种情况,过0.5mol作横轴的平衡线,再从交点作横轴的垂直线,利用比例关系计算;
D.当V(NaOH)=4.0 L时,沉淀完全溶解,生成偏铝酸钠和NaCl.
解答 解:A.由图可知,沉淀最多为1.00mol,其质量为1mol×78g/mol=78g,故A错误;
B.由图可知,加3L时NaOH恰好完全反应生成沉淀,Al(OH)3为1mol,由Al元素守恒,则AlCl3的物质的量为1mol,则AlCl3的浓度为$\frac{1mol}{0.5L}$=2.0mol/L,故B正确;
C.得到39g沉淀时,即为0.5mol,由图可知存在两种情况,过0.5mol作横轴的平衡线,再从交点作横轴的垂直线,如图所示: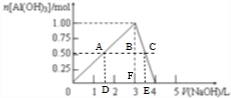 ,AD为三角形中位线,则D点体积为$\frac{1}{2}$×3L=1.5L,由方程式可知线段长度:AB=3BC,则FE=$\frac{1}{3}$DF=$\frac{1}{3}$×1.5L=0.5L,故E点体积=3L+0.5L=3.5L,故C正确;
,AD为三角形中位线,则D点体积为$\frac{1}{2}$×3L=1.5L,由方程式可知线段长度:AB=3BC,则FE=$\frac{1}{3}$DF=$\frac{1}{3}$×1.5L=0.5L,故E点体积=3L+0.5L=3.5L,故C正确;
D.当V(NaOH)=4.0 L时,沉淀完全溶解,生成偏铝酸钠和NaCl,得到的溶液中Na+、AlO2-、Cl-,故D错误,
故选BC.
点评 本题是化学方程式计算、化学反应图象等,侧重考查学生对图象的解读能力、分析计算能力等,明确发生的反应是解题关键,C选项中注意体会利用几何方法解答,题目难度中等.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
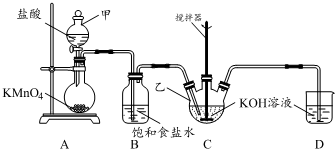 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
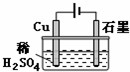
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主反应方程式为Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度几乎不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都能与水反应生成对应的酸 | |
| B. | 标准状况下它们都是无色无味的气体 | |
| C. | 分子中氧元素的质量分数:NO>NO2>SO2 | |
| D. | 实验室可以利用氧化还原反应分别制备NO、NO2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
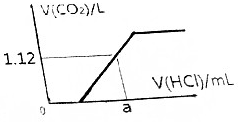 取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.
取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式:-CHO | B. | 甲烷的电子式: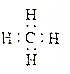 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
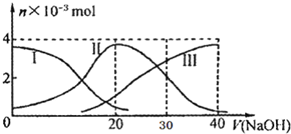 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2 c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com