
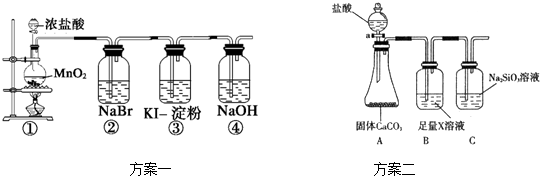
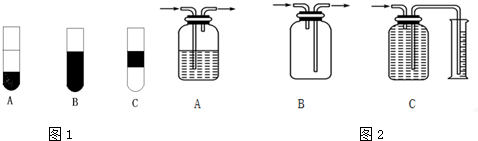
| ||
| ||


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
| D、向碳酸氢钠溶液中滴加少量稀硝酸:CO32-+2H +=CO2↑ +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
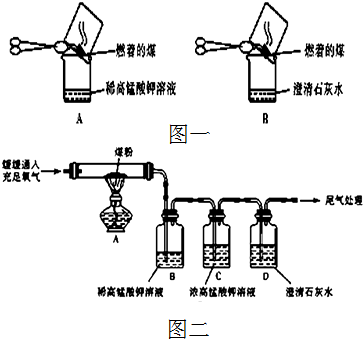
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
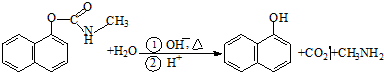
| A、西维因是一种芳香烃 |
| B、西维因分子中所有碳原子一定共面 |
| C、可用FeCl3溶液检验西维因是否发生水解 |
| D、在Ni催化下1mol西维因最多能与6molH2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com