
分析 A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子,原子核外电子排布式为1s22s22p2,故A为碳元素;C占整个地壳质量的48.6%,是地壳中含量最多的元素,则C为O元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性,则E为Cl;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属,F为Cu;D与F不同周期,但最外能层电子数相等,D的原子序数大于氧、小于Cl,可知D为Na,
(1)D为Na,处于第三周期IA族;
(2)同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,N原子原子2p轨道为半满稳定状态,能量较低;
(3)A、C两元素形成的化合物CO2的分子空间构型为直线形,原子数目相等、价电子总数也相等的微粒互为等电子体;
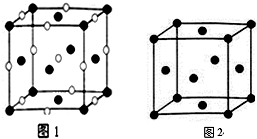
(4)利用均摊法计算晶胞中氯离子、钠离子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度;
(5)根据均摊法计算晶胞中F原子数目,进而计算晶胞中F原子总体积,面对角线上的原子相邻,晶胞棱长为面对角线长度的$\frac{\sqrt{2}}{2}$倍,计算晶胞体积,F原子在晶胞中的空间利用率=$\frac{原子体积}{晶胞体积}$.
解答 解:A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子,原子核外电子排布式为1s22s22p2,故A为碳元素;C占整个地壳质量的48.6%,是地壳中含量最多的元素,则C为O元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性,则E为Cl;F位于ds区,最外能层有单电子,是热和电最佳导体之一,是唯一的能大量天然产出的金属,F为Cu;D与F不同周期,但最外能层电子数相等,D的原子序数大于氧、小于Cl,可知D为Na,
(1)D为Na,其价电子排布式为:3s1,
故答案为:3s1;
(2)同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,氧原子的第一电离能小于氮原子的原因是,氧原子的3个2p轨道上排布4个电子,必然有一个2p轨道上占2个电子,这两个电子在同一个2p轨道上增大了相互之间的排斥力,使得氧原子容易失去一个电子,
故答案为:N;同一周期随着原子序数的递增,元素的第一电离能总体呈现增大趋势,N原子原子2p轨道为半满稳定状态,能量较低;
(3)A、C两元素形成的化合物CO2的分子空间构型为直线形,与CO2互为等电子体的粒子的化学式有N2O、NO2+ 等,
故答案为:直线型;N2O NO2+ 或BO2-;
(4)E为Cl、D为Na,晶胞中氯离子数目为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,钠离子数目为:1+12×$\frac{1}{4}$=4,则晶胞质量为:4×$\frac{58.5}{{N}_{A}}$g,晶胞的边长为n cm,则晶胞的密度ρ=4×$\frac{58.5}{{N}_{A}}$g÷(n cm)3=$\frac{234}{{n}^{3}•{N}_{A}}$g/cm3,
故答案为:$\frac{234}{{n}^{3}•{N}_{A}}$;
(5)晶胞中F原子数目为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,F原子的半径为r,则F原子总体积为:4×$\frac{4}{3}$πr3,晶胞棱长为4r×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r,则晶胞体积为(2$\sqrt{2}$r)3,则F原子在晶胞中的空间利用率为:$\frac{4×\frac{4}{3}π{r}^{3}}{(2\sqrt{2}r)^{3}}$=$\frac{\sqrt{2}π}{6}$,
故答案为:$\frac{\sqrt{2}π}{6}$.
点评 本题考查晶胞计算,题目难度较大,涉及核外电子排布、电离能、空间构型、等电子体、晶胞计算等知识,掌握均摊法进行晶胞有关计算,注意同周期第一电离能异常情况,试题培养了学生的分析、理解能力及化学计算能力.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:Li<Na<K<Rb<Cs | B. | 熔点、沸点:Li<Na<K<Rb<Cs | ||
| C. | 原子半径:Li<Na<K<Rb<Cs | D. | 氧化性:Li+<Na+<K+<Rb+<Cs+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
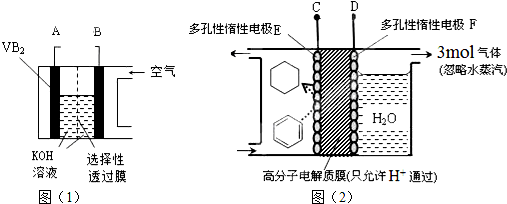
| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小2×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50% | B. | 48.8% | C. | 42.1% | D. | 72.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片放入氢氧化钠溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | Na与水反应:Na+2H2O═Na++H2↑+2OH- | |
| C. | 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | AlCl3溶液中滴入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com