
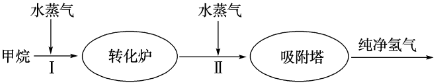
����Bay�ȹ���ʹ��ʯ�����ѽ�ĸ������������ȡ������������������
��ͼ��

��1�������̵ĵ�II����ӦΪ��CO��g��+H2O��g��![]() H2��g��+CO2��g�����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ����Ӧ��ƽ�ⳣ�����¶ȵı仯���һ��
H2��g��+CO2��g�����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ����Ӧ��ƽ�ⳣ�����¶ȵı仯���һ��
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
���ϱ������ƶϣ��˷�Ӧ��_______________ ������������š����ȷ�Ӧ����830���£�����ʼʱ������ܱ������г���CO��HzO��Ϊ1 mo1����ﵽƽ���CO��ת����Ϊ_____��
��2�������̵ĵ�II����ӦCO��g��+H2O��g��![]() H2��g��+CO2��g������830�棬�Ա��������ʵ�������λΪmol��Ͷ����ݷ�Ӧ������������Ӧ�����з�Ӧ��ʼʱ��������Ӧ������е��� ����ʵ���ţ���
H2��g��+CO2��g������830�棬�Ա��������ʵ�������λΪmol��Ͷ����ݷ�Ӧ������������Ӧ�����з�Ӧ��ʼʱ��������Ӧ������е��� ����ʵ���ţ���
| ʵ���� | N��CO�� | N��H2O�� | n��H2�� | N��CO2�� |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
��3����һ�������ȵĹ̶��ݻ��������У��жϴ����̵ĵ�II����Ӧ�ﵽƽ��ı�־��
�� ��ϵ��ѹǿ���ٷ����仯 �ڻ��������ܶȲ��� �ۻ�������ƽ����Է����������䡡 �� ����ֵ����ʵ���Ũ�Ȳ��ٸı� �� ��ϵ���¶Ȳ��ٷ����仯 �� v��CO2������ v��H2O�棩
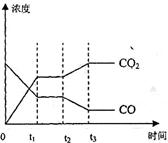
��4�� ͼ��ʾ�÷�Ӧ�����̵ĵ�II����Ӧ��ʱ��t![]() �ﵽƽ�⡢��ʱ��t
�ﵽƽ�⡢��ʱ��t![]() �ֱ���ı�ij�������������仯�������ͼ��ʱ��t
�ֱ���ı�ij�������������仯�������ͼ��ʱ��t![]() �����ı��������_________����д�����֣�
�����ı��������_________����д�����֣�
��5����400��ʱ���ڢ�Ӧ����l mol������������ֵΪ 33.2����λΪkJ�����ڢ�Ӧ���Ȼ�ѧ����ʽΪ�� CH4��g��+H2O��g��=3H2��g��+CO��g����H=-103.3 kJ��mol-1����400��ʱ�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽΪ ��
 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
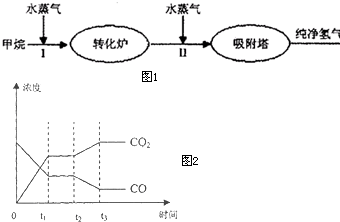 ����Bay�ȹ���ʹ��ʯ�����ѽ�ĸ������������ȡ������������������ͼ1��
����Bay�ȹ���ʹ��ʯ�����ѽ�ĸ������������ȡ������������������ͼ1��| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| ʵ���� | n��CO�� | n��H2O�� | n��H2�� | n��CO2�� |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� |
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| ʵ���� | n��CO�� | n��H2O�� | n��H2�� | n��CO2�� |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��14�֣�����Bay�ȹ���ʹ��ʯ�����ѽ�ĸ������������ȡ��������������������ͼ��
��1�������̵ĵ�II����ӦΪ��CO(g)��H2O(g)H2(g)��CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 830 |
| ƽ�ⳣ��K | 10 | 9 | 1 |
���ϱ������ƶϣ��˷�Ӧ�� ��������š����ȷ�Ӧ����830���£�����ʼʱ������ܱ������г���1mo1CO��2mo1H2O����ﵽƽ���CO��ת����Ϊ ��
��2����500�棬���±������ʵ���������CO��H2O��H2��CO2��˳��Ͷ������ܱ������н���������II����Ӧ���ﵽƽ������й�ϵ��ȷ����
| ʵ���� | ��Ӧ��Ͷ���� | ƽ��ʱH2Ũ�� | ���ջ�ų������� | ��Ӧ��ת���� |
| A | 1��1��0��0 | c1 | Q1 | ��1[��Դ:] |
| B | 0��0��2��2 | c2 | Q2 | ��2
|
| C | 2��2��0��0 | c3 | Q3 | ��3 |
A��2c1= c2 =c3 B��2Q1=Q2=Q3 C����1 =��2 =��3 D����1 +��2 =1
��3����һ�����ȵ��������У������жϴ����̵ĵ�II����Ӧ�ﵽƽ����� ��
����ϵ��ѹǿ���ٷ����仯 �ڻ��������ܶȲ���
�ۻ�������ƽ����Է����������� �ܸ���ֵ����ʵ���Ũ�Ȳ��ٸı�
����ϵ���¶Ȳ��ٷ����仯 ��v(CO2)����v(H2O)��
��4����ͼ��ʾ�����̵ĵ�II����Ӧ����t1ʱ�̴ﵽƽ�⡢��t2ʱ����ı�ij������Ũ�ȷ����仯�������ͼ��t2ʱ�̷����ı�������� ��
��д�����֣�����t4ʱ��ͨ���ı��ݻ��ķ�����ѹǿ����Ϊԭ�ȵ���������ͼ��t4��t5�����ڻ���CO��CO2Ũ�ȱ仯���ߣ����������ʣ����������״̬�����ֲ��䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��9�֣�����Bay�ȹ���ʹ��ʯ�����ѽ�ĸ������������ȡ������������������
��ͼ��
��1�������̵ĵ�II����ӦΪ��CO��g��+H2O��g�� H2��g��+CO2��g�����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ����Ӧ��ƽ�ⳣ�����¶ȵı仯���һ��
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
���ϱ������ƶϣ��˷�Ӧ��_______________ ������������š����ȷ�Ӧ����830���£�����ʼʱ������ܱ������г���CO��HzO��Ϊ1 mo1����ﵽƽ���CO��ת����Ϊ_____��
��2�������̵ĵ�II����ӦCO��g��+H2O��g�� H2��g��+CO2��g������830�棬�Ա��������ʵ�������λΪmol��Ͷ����ݷ�Ӧ������������Ӧ�����з�Ӧ��ʼʱ��������Ӧ������е��� ����ʵ���ţ���
| ʵ���� | N��CO�� | N��H2O�� | n��H2�� | N��CO2�� |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
��3����һ�������ȵĹ̶��ݻ��������У��жϴ����̵ĵ�II����Ӧ�ﵽƽ��ı�־��
�� ��ϵ��ѹǿ���ٷ����仯 �ڻ��������ܶȲ��� �ۻ�������ƽ����Է����������䡡 �� ����ֵ����ʵ���Ũ�Ȳ��ٸı� �� ��ϵ���¶Ȳ��ٷ����仯 �� v��CO2������ v��H2O�棩
��4�� ͼ��ʾ�÷�Ӧ�����̵ĵ�II����Ӧ��ʱ��t![]() �ﵽƽ�⡢��ʱ��t
�ﵽƽ�⡢��ʱ��t![]() �ֱ���ı�ij�������������仯�������ͼ��ʱ��t
�ֱ���ı�ij�������������仯�������ͼ��ʱ��t![]() �����ı��������_________����д�����֣�
�����ı��������_________����д�����֣�
��5����400��ʱ���ڢ�Ӧ����l mol������������ֵΪ 33.2����λΪkJ�����ڢ�Ӧ���Ȼ�ѧ����ʽΪ�� CH4��g��+H2O��g��=3H2��g��+CO��g����H=-103.3kJ��mol-1����400��ʱ�������ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com