
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
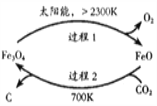
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:
①捕获1molCO2转移电子的物质的量是_________。
②过程2反应的化学方程式是__________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
按投料比n(CO2) : n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
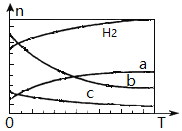
①正反应的焓变△H_______0 。
②提高CO2的转化率,可采用的方法是_______。
A.减小n(CO2)与n(H2)的投料比
B.改变催化剂
C.缩小容器体积
③图中表示乙烯的曲线是_______。
(3)以NH3与CO2为原料,合成尿素[化学式:CO(NH2)2]:
反应如下:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol
③H2O(l)=H2O(g) △H=+44.0kJ/mol
CO2与NH3形成液态水时,合成尿素的热化学方程式是_______________;
(2)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极,将CO2转化为丙烯的原理模型。
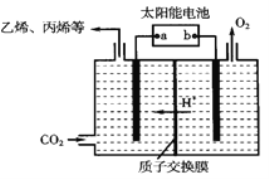
①太阳能电池的负极是_________。
②生成丙烯的电极反应式是__________。
【答案】 4mol 6FeO + CO2 = 2Fe3O4 + C △H<0 ac c 2NH3(g)+CO2(g)= CO(NH2)2(s)+ H2O(l) △H = -87kJ/mol a 3CO2 + 18H+ + 18e- = CH2=CH-CH3 + 6H2O
【解析】(1)①捕获1molCO2生成1molC,化合价从+4价升高到0价,因此转移电子的物质的量是4mol。②过程2反应是氧化亚铁被CO2氧化为四氧化三铁,反应的化学方程式是6FeO+CO2 = 2Fe3O4 + C。(2)①随着温度的升高,氢气的物质的量增加,说明升高温度平衡向逆反应方向进行,则正反应的焓变△H<0。②A.减小n(CO2)与n(H2)的投料比,相当于增大氢气浓度,有利于提高CO2转化率,A正确;B.改变催化剂不能改变平衡状态,转化率不变,B错误;C.正反应体积减小,缩小容器体积,压强增大,平衡向正反应方向进行,转化率升高,C正确,答案选AC。③乙烯是生物物,物质的量小于水蒸气,所以图中表示乙烯的曲线是c。(3)已知:① 2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol,②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H=+116.5kJ/mol,③H2O(l)= H2O(g) △H=+44.0kJ/mol,则根据盖斯定律可知①+②-③即得到合成尿素的热化学方程式是2NH3(g)+CO2(g)= CO(NH2)2(s)+ H2O(l) △H = -87kJ/mol;(4)①与电源b相连的产生氧气,氢氧根放电,说明该电极是阳极,b是正极,则太阳能电池的负极是a。②丙烯在阴极产生,则生成丙烯的电极反应式是3CO2 +18H+ +18e- = CH2=CH-CH3 + 6H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A. 一定条件下,将1g乙炔溶于12g苯,所得混合物中含有的碳原子数为NA
B. l04g苯乙烯(C6H5-CH=CH2)中含有8NA个碳氢键和NA个碳碳双键
C. 在100g质量分数为46%的乙醇水溶液中,含有氢原子数为6NA
D. lmol有机物CH3-CH=CH-CH3中最多有8NA个原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
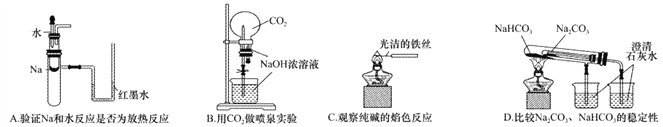
A. A B. B C. C D. D
【答案】D
【解析】A.钠与水反应放热,试管中温度升高,导致气体压强增大,红墨水出现液面差,可以达到实验目的,A正确;B.二氧化碳与氢氧化钠反应,压强减小,形成喷泉,可以达到实验目的,B正确;C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,能够达到实验目的,C正确;D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,题中装置无法达到实验目的,D错误;答案选D。
【题型】单选题
【结束】
18
【题目】下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
A. 氢氧化钠与二氧化碳反应 B. 盐酸和碳酸氢钠溶液
C. 铜与硝酸反应 D. 氯化铝溶液和氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氧化钠溶液、②铜片、③碳酸钙、④蔗糖、⑤熔融的NaCl、⑥SO2气体、⑦碳酸氢钠、⑧盐酸
(1)能导电且属于电解质的是___________。(填编号)
(2)写出碳酸钙的电离方程式____________________________________。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式____________________________________。
(4)向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
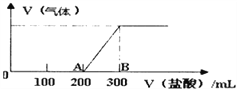
则
①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为_________(写化学式)。
②盐酸的浓度为________________________。
③B点时,产生的气体在标准状况下的体积为_________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铜粉加入到0.5 L 0.3 mol·L-1 Fe2(SO4)3和0.1 mol·L-1 H2SO4的混合溶液中,铜粉完全溶解后,得到溶液X。下列说法正确的是 ( )
A. 溶液X中Cu2+与Fe2+的物质的量之比为2∶1
B. 向溶液X中加入足量铁粉,充分反应后,铁粉质量减少11.2 g
C. 向溶液X中滴加KSCN溶液,未变红色,则加入铜粉质量为12.8 g
D. 向溶液X中加入0.18 L 5 mol·L-1 NaOH溶液可使溶液中的金属离子完全沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
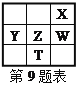
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮可以去除油污,还可以_____________。
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是____________→ 洗涤 →__________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是__________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。请写出酸性条件下![]() 与
与![]() 反应的离子方程式______(
反应的离子方程式______(![]() 被还原为
被还原为![]() )。
)。
(5)若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取__________g ,K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有_______ (用编号表示)。
①电子天平 ②烧杯 ③锥形瓶 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(6)若配制![]() 标准溶液时,俯视刻度线,则测定结果________(填“偏大”、“偏小”或“不变”,下同)。滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_________ 。
标准溶液时,俯视刻度线,则测定结果________(填“偏大”、“偏小”或“不变”,下同)。滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定物质的量浓度的NaOH溶液100 mL,向其中通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积 (标准状况)与所加HCl溶液的体积之间关系如图所示,请回答:

(1)A溶液中的溶质_________。(用化学式表示)
(2)通入的CO2的体积(标准状况)为_______ mL。
(3)NaOH溶液的物质的量浓度_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com