

| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
分析 某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)与稀硫酸反应,Cu2O与酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Al2O3与盐酸反应生成Al3+,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体混合物A为SiO2和Cu,滤液中含有Cu2+、Fe2+、Al3+,加入足量的NaClO溶液,调节pH氧化Fe3+并使其以氢氧化物的形式沉淀,沉淀B为Fe(OH)3,向滤液中加入NaOH溶液,调节pH沉淀Al3+并使其以氢氧化物的形式沉淀,沉淀C为Al(OH)3,滤液主要含有Cu2+、Na+,经过电解可得纯铜,以此解答该题.
解答 解:(1)Cu2O与酸反应生成Cu和Cu2+,SiO2与盐酸不反应,固体混合物A为SiO2和Cu;
故答案为:SiO2和Cu;
(2)Cu2O与酸反应生成Cu和Cu2+,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+:2Fe3++Cu=2Fe2++Cu2+,滤液中铁元素为Fe2+;
故答案为:Fe2+;2Fe3++Cu=2Fe2++Cu2+;
(3)沉淀B为Fe(OH)3,调节pH沉淀铁离子,不沉淀其他离子,根据表中数据可知3.2≤X<4.0可满足;
故答案为:3.2≤X<4.0;
(4)沉淀C为Al(OH)3,灼烧得到氧化铝,电解熔融态的氧化铝可得铝,涉及的反应为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
故答案为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
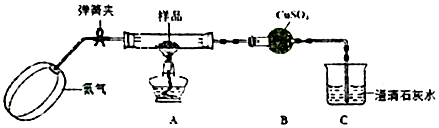
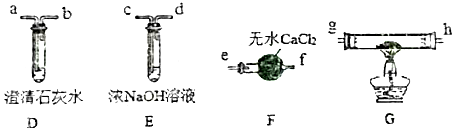
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IVA族元素氢化物沸点顺序是GeH4>SiH4>CH4,则VA族元素氢化物沸点顺序也是AsH3>PH3>NH3 | |
| B. | 常见的氢化物是分子晶体,则所有氧化物都是分子晶体 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| D. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
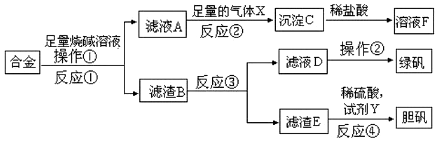
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (3)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图2:
(3)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图2:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L 已烷中含有共价键的数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中所含碳原子数为2NA | |
| D. | 足量Fe与1 mol Cl2充分反应,转移的电子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com