
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 硝酸铵溶于水温度降低,这个过程吸热热量 | |
| C. | 同温同压下,H2和Cl2在光照和点燃条件下的△H不同 | |
| D. | 自发反应的熵一定增大,非自发反应的熵一定减小 |
分析 A、任何化学反应都有能量变化;
B、温度降低,则吸热热量;
C、焓变与反应条件无关;
D、反应自发与否,决定于熵变和焓变两个因素.
解答 解:A、化学反应的实质是旧键的断裂和新键的形成,旧键断裂吸收热量,形成新键放出热量,则化学反应一定伴有能量变化,故A错误;
B、硝酸铵溶于水温度降低,则这个过程吸热热量,故B正确;
C、焓变与反应条件无关,H2和Cl2在光照和点燃条件下的△H相同,故C错误;
D、焓变和熵变共同决定反应是否自发,所以自发反应的熵不一定增大,非自发反应的熵也不一定减小,故D错误;
故选B.
点评 本题考查了化学反应的实质、吸热过程、反应自发与否的条件以及焓变与反应条件无关,题目难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
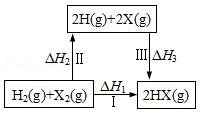
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2>0 | |
| B. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| C. | 若X分别表示Cl,Br,I,则过程Ⅱ吸收的热量依次增多 | |
| D. | △H1代表H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cl-、NO3-、K+ | B. | HCO3-、K+、SO42-、Cl- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | Na+、Cl-、K+、SO42-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用分液漏斗分离乙酸乙酯与乙醇的混合物 | |
| C. | 用NaOH溶液除去乙酸乙酯中混有的乙酸 | |
| D. | 用排水集气法收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
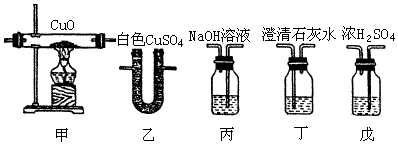
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
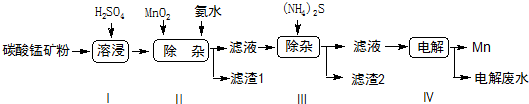
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
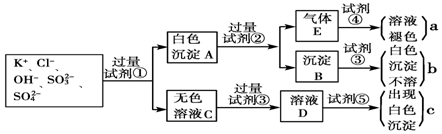
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com