
| A. | 用乙烯合成聚乙烯 | |
| B. | 分馏石油得到汽油、柴油、重油等产物 | |
| C. | 铝铁在冷、浓硫酸中钝化 | |
| D. | 食物腐败变酸 |
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:实验题
 在2L的密闭容器中,高温下发生下列反应:
在2L的密闭容器中,高温下发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
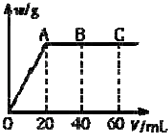 有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).
有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 补血剂中铁元素的化合价为+2价 | |
| B. | 铝是人体中的一种微量元素,如果摄入量过多,易患老年痴呆症 | |
| C. | 铝能溶解于氢氧化钠溶液中,而铁不能与氢氧化钠溶液反应 | |
| D. | 铝的导热性比铁强,因而用铝锅煮食物比铁锅好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲=丙>乙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=乙=丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶于盐酸:CaCO3+2 H+→Ca2++H2O+CO2↑ | |
| B. | 氯水滴加到碘化钾溶液中:Cl2+I-→I2+Cl- | |
| C. | 铁和硫酸铜溶液反应:Fe+Cu2+→Fe2++Cu | |
| D. | 醋酸溶液和氢氧化钾溶液混合:CH3COOH+OH-→CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-283.0 kJ/mol | |
| B. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=-11 036 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com