
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C | 在容积可变的密闭容器中发生反应:2NH3(g)?N2H4(l)+H2(g),把容积的体积缩小一半 | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| 稀H2SO4 |
| ① |
| 调PH约为5 |
| 适量高锰酸钾溶液② |
| 过滤 |
| Zn |
| ③ |
| 过滤 |
| Na2CO3 |
| ④ |
| 过滤 |
| 煅烧 |
| ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200mL |
| B、245mL |
| C、250mL |
| D、300mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、NaHCO3 |
| C、Na2CO3和NaOH |
| D、Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干 | ||
| B、用CCl4提取碘水中的碘,选③ | ||
C、蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
| ||
| D、粗盐提纯,选①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.24mol |
| B、0.21mol |
| C、0.18mol |
| D、0.14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH |
| B、C2H5OH |
| C、C3H7OH |
| D、C4H9OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾 |
| B、二氧化氯 |
| C、臭氧 |
| D、高铁酸钠( Na2FeO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
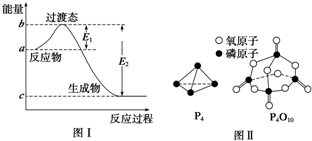
| 1 |
| 2 |
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ?mol-1 | a | b | c | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com