
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
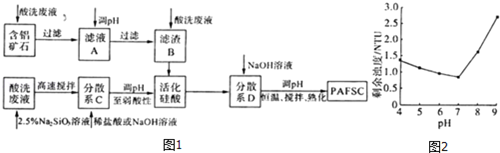
分析 (1)可用KSCN检验Fe3+,Fe2+和Cl-都可被酸性高锰酸钾氧化;
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,应生成氯气,向上述酸洗废液中加入KOH溶液中和后,生成K2FeO4,Fe元素被氧化,应为阳极反应;
(3)含铝矿石加入酸,然后过滤可除去SiO2,滤液中含有Al3+、Fe3+,适当调高滤液A的pH,Al3+和Fe3+转化为沉淀,然后加入酸溶解,与活化硅酸反应,并加入氢氧化钠调节pH,充分搅拌可得聚硅酸氯化铝铁絮凝剂.
①适当调高滤液A的pH,可增大溶液中[OH-],有利于平衡向生成沉淀的方向移动;
②PAFSC絮凝剂净化水的过程中,Al3+水解生成氢氧化铝胶体;
③由图象可知pH介于5~7时剩余浊度较低,除浊效果较好,pH>7且随pH增大,PAFSC的除浊效果明显变差,说明胶体吸附能力减弱,可能发生聚沉.
解答 解:(1)可用KSCN检验Fe3+,Fe2+和Cl-都可被酸性高锰酸钾氧化,发生2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,导致紫色消失,
故答案为:KSCN;酸性KMnO4溶液会氧化Cl-,导致紫色消失,2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,应生成氯气,电极方程式为2Cl--2e-=Cl2↑,向上述酸洗废液中加入KOH溶液中和后,生成K2FeO4,Fe元素化合价升高被氧化,应为阳极反应,
故答案为:2Cl--2e-=Cl2↑;阳;
(3)含铝矿石加入酸,然后过滤可除去SiO2,滤液中含有Al3+、Fe3+,适当调高滤液A的pH,Al3+和Fe3+转化为沉淀,然后加入酸溶解,与活化硅酸反应,并加入氢氧化钠调节pH,充分搅拌可得聚硅酸氯化铝铁絮凝剂.
①适当调高滤液A的pH,可增大溶液中[OH-],Al(OH)3和Fe(OH)3的Qc大于其Ksp,从而使Al(OH)3和Fe(OH)3的沉淀溶解平衡向沉淀方向移动),
故答案为:调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的Qc大于其Ksp;(或调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的沉淀溶解平衡向沉淀方向移动);
②PAFSC絮凝剂净化水的过程中,Al3+水解生成氢氧化铝胶体,离子方程式为Al3++3H2O=Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+;
③由图象可知pH介于5~7时剩余浊度较低,除浊效果较好,pH>7且随pH增大,PAFSC的除浊效果明显变差,说明胶体吸附能力减弱,可能发生聚沉,
故答案为:b;聚沉.
点评 本题综合考查物质的分离、提纯以及实验方案的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 验证某有机物属于烃,完成的实验只要证明它完全燃烧后的产物只有H2O和CO2 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 黄酒中存在的某些微生物可以使部分乙醇氧化,转化为乙酸,酒就有了酸味 | |
| D. | 乙烯使酸性高锰酸钾溶液,溴的四氯化碳溶液褪色,由于乙烯发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4 L氖气含有原子数为NA | |
| C. | 物质的量浓度为2 mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 标准状况下,11.2 L H2O含有0.5NA分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2═I2+2Br- | |
| C. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2═2Fe3++I2+4Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com