
【题目】工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下:

已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;请回答下列问题:
(1)酸浸时如何提高浸取速度和浸取率_____________________________(至少答两种方法)。
(2)“水解”生成H2TiO3的离子方程式为_________________________。
(3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。
(4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.0×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________。
(6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O![]() ===S4O
===S4O![]() +2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。
【答案】升温、搅拌、适当增大硫酸浓度、粉碎矿石 TiO2++2H2O=H2TiO3↓+2H+ ![]() 温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗
温度过高容易导致NH4HCO3分解(或防止Fe2+、Mg2+等受热水解) 11 阳 阳极产生氧气与石墨反应生成二氧化碳,导致阳极损耗 ![]()
【解析】
根据流程:用硫酸酸浸钛铁矿(主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质),SiO2不溶,钛酸亚铁、氧化镁溶解,过滤,滤渣1为SiO2,滤液1含有Fe2+、TiO2+、Mg2+,水解滤液1发生反应:TiO2++2H2O=H2TiO3↓+2H+,过滤得到H2TiO3,煅烧H2TiO3得到TiO2,电解得到Ti;滤液2主要含有Fe2+、Mg2+,加入碳酸氢铵沉铁反应:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,得到FeCO3沉淀和含有Mg2+的滤液3,FeCO3与氧气煅烧得到铁红,据此分析作答。
(1)适当升温。搅拌、适当增大六三浓度、粉碎矿石等可以提高浸取速度和浸取率;
(2)根据分析,滤液1含有TiO2+,水解生成H2TiO3,离子反应为:TiO2++2H2O=H2TiO3↓+2H+;
(3)“沉铁”过程中生成的气体是二氧化碳,其电子式为![]() ;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
;温度过高溶液导致碳酸氢铵分解(或防止Fe2+、Mg2+等受热水解),过沉铁过程过程需控制反应温度低于35℃;
(4)已知:Ksp[Mg(OH)2]=1.0×10-11,使Mg2+恰好沉淀完全,此时c(OH-)= ![]() mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
mol/L=1.0×10-3mol/L,c(H+)=1.0×10-11mol/L,故pH≥11,Mg2+沉淀完全;
(5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒,阳极反应为:2O2--4e-=O2↑,阳极产生的氧气与石墨反应生成二氧化碳,导致阳极损耗,故阳极石墨棒需要定期更换;
(6)铁红溶于稀硫酸得到Fe3+,与KI发生反应:2Fe3++2I-=2Fe2++I2,用硫代硫酸钠(Na2S2O3)标准液滴定生成的碘,有关系式:Fe2O3~2Fe3+~I2~2Na2S2O3,则n(Fe2O3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() cV×10-3mol,故mg样品中铁红产品的纯度为
cV×10-3mol,故mg样品中铁红产品的纯度为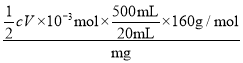 ×100%=
×100%=![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.某氨水的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b-1
B.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
D.若10mLpH=a的硫酸溶液跟100mLpH=b的NaOH溶液混合后,溶液呈中性,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,b与d的最外层电子数之和为a与c最外层电子数之和的四倍。下列叙述不正确的是
A. 原子半径:c>d>a
B. d的氧化物对应的水化物酸性均比b的强
C. a、b、d三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
Ⅰ.含氯消毒剂在生产生活中有极其重要的作用。
(1)Cl2常用于自来水的杀菌消毒。Cl2溶于水后,溶液中具有氧化作用的含氯微粒除Cl2外还有______________。
(2)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质。其原因:一是_________________________________ (用离子方程式和相应的文字解释),二是生成的Fe(OH)3胶体具有较强的吸附 性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。
(3)KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。常用作消毒剂,其变化可以表示为:2KClO3+4HCl(浓) = 2KCl+2ClO2↑+Cl2↑+2H2O,若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:_______________________。
Ⅱ.铁的化合物高铁酸钠(Na2FeO4)是一种新型净水剂。
(1)高铁酸钠主要通过反应制取:2Fe(OH)3+3X+ 4NaOH=2Na2FeO4+3NaCl+ 5H2O,则X的化学式为_____________。
(2)高铁酸钠在水中可以发生反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
Ⅲ.(1)H2O2可作为矿业废液消毒剂,有“绿色氧化剂”的美称。H2O2被称为“绿色氧化剂”的理由是________________________________。
(2)取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①加适量H2O2,紫红色褪去,并有气泡产生;
②加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③后通入足量SO2,发生反应:5SO2+2MnO4-+5Pb2++2H2O==5PbSO4↓+2Mn2++4H+。
则KMnO4、H2O2、PbO2氧化性由强到弱的顺序为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚醛树脂是1907年世界上第一个合成的高分子材料。它是用酚类(如苯酚)与醛类(如甲醛)在酸或碱的催化下相互缩合而成的。如图是实验室制取酚醛树脂的装置图(该实验所用催化剂为浓盐酸)。下列说法错误的是

A.装置中玻璃导管的作用是冷凝回流
B.试管中发生的反应是:
C.待制备实验结束后,取出试管,冷却至室温,加入适温乙醇,并加热,沉淀溶解,说明酸性条件下制得的酚醛树脂为网状结构
D.实验完毕后,若试管用水不易洗涤,可以加入少量乙醇浸泡几分钟,然后洗净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)

④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式___________。
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式___________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母)

A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________。
(6)为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5~10.5,试分析原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为三种短周期元素,在元素周期表中,X的原子半径最小,Z的非金属性最强。又知,Y原子的最外层电子数比次外层电子数多4个,X、Y能形成甲、乙两种化合物,乙中X和Y的原子个数比为1:1。
(1)X、Y、Z的元素符号为:X _____Y ________Z_________;
(2)甲中存在的化学键类型为________________________;
(3)Z的原子结构示意图为___________________________;
(4)向甲和乙的混合物中加入少量MnO2,发生反应的化学方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其制作的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是( )

A. 电池工作时,正极附近的pH降低
B. 当消耗1 mol O2时,有2 mol Na+由甲槽向乙槽迁移
C. 负极反应为4OH-+N2H4-4e-===N2↑+4H2O
D. 若去掉阳离子交换膜,电池也能正常工作
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com