
| 25℃平衡体系 | HA起始总浓度 |
| 在水中,HA═H++A- | 4.0×10-3mol•L-1 |
| 在苯中,2HA═(HA)2 | 5.0×10-3mol•L-1 |
分析 根据K=$\frac{c(HA)_{B}}{c(HA)_{W}}$=1.0及HA在水溶液中的物质的量浓度计算出苯体系中HA的转化率.
解答 解:水中HA的物质的量浓度为:4.0×10-3mol•L-1×0.7=2.8×10-3mol•L-1,由于以分子形式存在的HA在苯和水两种溶剂中的比例为1:1,所以苯体系中HA的浓度为2.8×10-3mol•L-1,发生转化的HA的物质的量浓度为:(5.0×10-3-2.8×10-3)mol/L=2.2×10-3mol•L-1,在苯体系中HA的转化率为:$\frac{2.2×1{0}^{-3}}{5.0×1{0}^{-3}}$×100%=44%,
故答案为:44%.
点评 本题考查了化学平衡的计算知识,题目难度较大,注意掌握根据化学平衡进行的计算方法是关键.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
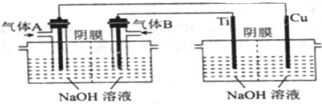 (1)工业上可利用CO2和H2生产甲醇,方程式如下:
(1)工业上可利用CO2和H2生产甲醇,方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:1 | B. | 1:5 | C. | 5:9 | D. | 9:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
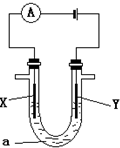
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与二氧化碳反应 | B. | 铁和稀硫酸的反应 | ||
| C. | 氢氧化钡晶体的粉末和稀硫酸混合 | D. | 木炭在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中c(NH4+)与c(NH2-)的乘积为一常数 | |
| B. | 液氨电离达到平衡时,各微粒的浓度保持不变 | |
| C. | 只要不加入其它物质c(NH4+)=c(NH2-) | |
| D. | 液氨中存在NH3、NH4+、NH2-、H2O、NH3•H2O等粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com