
| A、HClO=ClO-+H+ |
| B、Cl-+H2O?HCl+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++2H2O?NH3.H2O+H3O+ |


科目:高中化学 来源: 题型:
| A、电解MgCl2饱和溶液制取金属镁 |
| B、SO2具有还原性,可使酸性KMn04溶液退色 |
| C、双氧水被称为绿色氧化剂,是因为其还原产物为O2 |
| D、新制备的氯水中存在三种分子、四种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业常采用合适的催化剂 |
| B、配制FeCl2溶液时在溶液中加入少量铁粉 |
| C、NO2与N2O4的平衡体系加压,气体颜色会变深 |
| D、向重铬酸钾溶液中滴加几滴氢氧化钠溶液后,溶液由橙色变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
| B、在标准状况下,11.2LSO3所含分子数为0.5NA |
| C、1molNa与足量O2反应生成Na2O或Na2O2均失去NA电子 |
| D、两份质量为5.6g的铁分别与足量的盐酸、氯气反应,电子转移总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、PCl3的水解产物是PH3和HClO |
| C、Mg3N2的水解产物是Mg(OH)2和NH3 |
| D、SiCl4的水解产物是H4SiO4与HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2与水反应:3NO2+H2O═2NO3-+NO+2H+ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D、将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道上电子全充满或半充满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
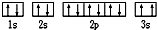 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com