
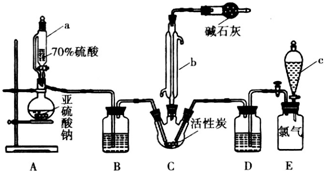
分析 (1)仪器a为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体流下;
(2)由仪器A的结构特征,可知A为冷凝管;
(3)利用分液漏斗中的液体将装置E的氯气排出,与二氧化硫在装置C中反应,分液漏斗可以为饱和食盐水;
根据氯气的量计算硫酰氯的理论产量,产量=(实际产量÷理论产量)×100%;
提高本实验中硫酰氯的产率,可以控制气体流速,使其充分反应,该反应为放热反应,可以对三颈烧瓶进行适当的降温;
(4)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4,二者沸点相差较大,采取蒸馏法进行分离;
(5)二氧化硫溶液与氯水都可以漂白品红溶液,若二者恰好完全反应得到盐酸、硫酸,不能使品红溶液褪色;
(6)100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气,氯气为黄绿色气体,可能是溶解氯气所致.
解答 解:(1)仪器a为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体顺利流下,
故答案为:平衡分液漏斗内外气压,便于液体顺利流下;
(2)由仪器b的结构特征,可知b为冷凝管,
故答案为:冷凝管;
(3)利用分液漏斗中的液体将装置E的氯气排出,与二氧化硫在装置C中反应,分液漏斗可以为饱和食盐水;
氯气的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,由方程式可知n(SO2Cl2)=n(Cl2)=0.05mol,故理论上生成SO2Cl2的质量为0.05mol×135g/mol=6.75g,故其产率为$\frac{5.4g}{6.75g}$×100%=80%;
为提高本实验中硫酰氯的产率,可以控制气体流速,宜慢不宜快,使其充分反应,由于100℃以上SO2Cl2开始分解,该反应为放热反应,可以对三颈烧瓶进行适当的降温,
故答案为:饱和食盐水;80%;控制气体流速,宜慢不宜快或对三颈烧瓶进行适当的降温等;
(4)氯磺酸(C1SO3H)加热分解,也能制得硫酰氯(SO2Cl2)与另外一种物质,由元素守恒可知,另外物质含有H元素,C1SO3H中S、Cl原子数目之比为1:1,而SO2Cl2中S、Cl原子数目之比为1:2,故另外物质中含有S元素,结合原子守恒可知另外物质为H2SO4,反应方程式为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;
二者为互溶液体,沸点相差较大,采取蒸馏法进行分离,
故答案为:2C1SO3H$\frac{\underline{\;\;△\;\;}}{\;}$SO2Cl2+H2SO4;蒸馏;
(5)二氧化硫溶液与氯水都可以漂白品红溶液,若二者恰好完全反应得到盐酸、硫酸,不能使品红溶液褪色,检验方案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应,
故答案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应;
(6)100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气,氯气为黄绿色气体,可能是溶解氯气所致,
故答案为:溶解硫酰氯分解生成的氯气.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 水结冰后体积膨胀的原因是由于水分子内存在氢键造成的 | |
| B. | F2、Cl2、Br2、I2由于组成结构相似,相对分子质量逐渐增大,分子间作用力逐渐增大,所以熔沸点逐渐升高 | |
| C. | 根据元素周期表的知识判断51Sb是一种可以作为半导体材料的非金属元素 | |
| D. | 碳元素有多种核素,如12C、13C、14C、C60它们互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯、氯水、次氯酸都具有漂白性 | |
| B. | 红热的铜丝在Cl2中燃烧产生棕黄色的雾;H2在Cl2中燃烧,火焰呈淡蓝色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 氯气、氯水都可以与硝酸银溶液反应生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al 是地壳中含量最多的金属元素 | |
| B. | Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性 | |
| C. | 实验室里常用铝盐溶液与氢氧化钠反应来制备氢氧化铝 | |
| D. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿斯巴甜中含有肽键-CONH- | |
| B. | 阿斯巴甜水解时生成苯丙氨酸、天冬氨酸和甲醇 | |
| C. | 阿斯巴甜易受环境影响而失去甜味,含有阿斯巴甜的食品不宜加热 | |
| D. | 阿斯巴甜中加入双缩脲试剂呈现紫玫瑰色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a+2}^{a+b+2}$R | C. | ${\;}_{a-2}^{a+b}$R | D. | ${\;}_{a+2}^{a+b+2}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | A | B | C | D |
| 实验 方案 |  | 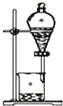 | 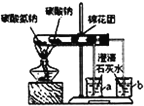 | 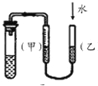 |
| 实验 目的 | 用铜与稀硝酸制取少量NO | 分离乙醇和苯 | 碳酸钠、碳酸氢钠热稳定性比较 | 检验装置的气密性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com