
【题目】现有等体积的硫酸、盐酸和醋酸三种溶液,将它们分别与V1L、V2L、V3L等浓度的NaOH溶液混合,下列说法中正确的是( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1<V2<V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1=V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后再与足量锌片反应,则醋酸溶液放出气体最多
【答案】D
【解析】
A.若三种溶液浓度相等,体积相等, 硫酸中![]() 最大,醋酸是弱电解质,盐酸是强电解质,所以反应后溶液呈中性时,需要NaOH溶液体积V1>V2>V3,故A错误;
最大,醋酸是弱电解质,盐酸是强电解质,所以反应后溶液呈中性时,需要NaOH溶液体积V1>V2>V3,故A错误;
B.若混合前三种溶液的pH相等,则醋酸浓度大于盐酸,盐酸中氢离子浓度和硫酸中氢离子浓度相等,恰好中和时,需要氢氧化钠溶液的体积V1=V2<V3,故B错误;
C.若混合前三种溶液物质的量浓度相等,等体积时,酸碱恰好完全中和时硫酸中![]() 最大,所以硫酸需要的NaOH溶液体积最多,盐酸和醋酸的物质的量相等,需要的NaOH溶液体积相等,所以其体积大小顺序是V1>V2=V3,故C错误;
最大,所以硫酸需要的NaOH溶液体积最多,盐酸和醋酸的物质的量相等,需要的NaOH溶液体积相等,所以其体积大小顺序是V1>V2=V3,故C错误;
D.若混合前三种溶液的pH相等,醋酸是弱电解质,盐酸、硫酸是强电解质,稀释相同的倍数,促进醋酸电离,所以溶液醋酸中氢离子浓度最大,但盐酸、硫酸中氢离子浓度相等,与足量锌片反应,醋酸放出的气体最多,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
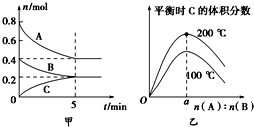
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04molL-1min-1
B.200℃时,该反应的平衡常数为25L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:
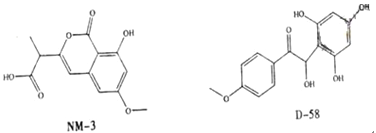
关于NM-3和D-58的叙述,错误的是
A.都能与![]() 溶液反应,原因不完全相同
溶液反应,原因不完全相同
B.都能与溴水反应,原因不完全相同
C.都不能发生消去反应,原因相同
D.遇![]() 溶液都显色,原因相同
溶液都显色,原因相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.铜溶于氯化铁浓溶液中:Cu + Fe3+=Cu2+ + Fe2+
B.NH4HCO3溶液中加入过量氢氧化钠稀溶液:NH![]() + OH- =NH3·H2O
+ OH- =NH3·H2O
C.碳酸银溶于稀硝酸:Ag2CO3 + 2H+ =2Ag++ CO2↑+ H2O
D.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①![]()
![]()
②![]()
![]()
下列判断不正确的是( )
A.①中的![]() 为固态,②中的
为固态,②中的![]() 为气态
为气态
B.①的反应物总能量比②的反应物总能量高
C.反应①的产物与反应②的产物热稳定性相同
D.1mol 固态碘完全升华会吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.钠与水反应:Na+H2O==Na++OH-+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=![]() +4
+4![]() +2H2O
+2H2O
C.FeCl3溶液净水原理:Fe3++3H2O=Fe(OH)3↓+3H+
D.用饱和Na2CO3溶液处理重晶石:BaSO4+![]() -==BaCO3+
-==BaCO3+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) (正反应放热)。下列说法正确的是( )
2SO3(g) (正反应放热)。下列说法正确的是( )
容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
SO2 | O2 | SO3 | ||||
I | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 |
II | 绝热恒容 | 1.0 L | 2 | 1 | 0 | a |
III | 恒温恒压 | 0.5 L | 0 | 0 | 1 | b |
A.a>1.6
B.b<0.8
C.平衡时v正(SO2):v(I)<v(II)
D.若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0 mol SO3(g),则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是
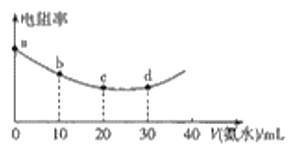
A.电阻率与离子浓度和离子所带电荷有关
B.a、b、c、d四点中,水的电离程度最大的是c
C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-)
D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员在钠离子电池研究中又取得新突破。钠离子电池与锂离子电池工作原理相同、制造工艺相似,而且具有资源丰富、成本低廉、安全性能好等特点。一种钠离子电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解质溶液为的碳酸丙烯酯溶液。
回答下列问题:
(1)基态Na原子的电子排布式为__,最高能层电子云轮廓图形状为___。
(2)Te与S同主族,与![]() 同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
(3)碳酸丙烯酯的结构简式为![]() ,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
(4)C元素的最高价氧化物的电子式为___,CO32-的VSEPR模型名称是___,ClO4-的立体构型是__。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是__,该配离子包含的作用力为___(填选项字母)。
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移___(填“是”或者“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com