
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
(1)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 .
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.图表示在其他条件不变时,反应:2CO(g)+2NO(g)2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H0 (填“>”或“<”).
②若催化剂的表面积S1>S2 , 在右图中画出c (NO) 在T1、S2条件下达到平衡过程中的变化曲线 . 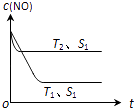
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:![]()
时间/s | 0 | 1 | 2 | 3 | 4 |
c (NO)(×10﹣3 molL﹣1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
c (CO)(×10﹣3 molL﹣1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
不考虑温度变化对催化剂催化效率的影响,按要求完成以下计算(写出计算过程,只写出计算结果的不给分):①计算前2s内的△c (CO2);
②计算前2s内的平均反应速率v (N2);
③计算达到平衡时NO的转化率.
【答案】
(1)2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=﹣752.1 kJ?mol﹣1
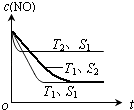
(2)<;
(3)
解:
2CO(g) | + | 2NO(g) | 2CO2(g) | + | N2(g) | ||
起始浓度(×10﹣3 molL﹣1) | 3.00 | 1.00 | 0.80 | 0.40 | |||
2s末浓度(×10﹣3 molL﹣1) | 2.20 | 0.20 | 0.80 | 0.40 | |||
2s变化浓度(×10﹣3 molL﹣1) | 0.80 | 0.80 | 0.80 | 0.40 | |||
平衡浓度(×10﹣3 molL﹣1) | 2.10 | 0.10 | 0.90 | 0.45 |
①△c (CO2)=0.80 molL﹣1,答:前2s内的△c (CO2)为0.80 molL﹣1 ;
②v (N2)= ![]() =0.20 molL﹣1s﹣1,
=0.20 molL﹣1s﹣1,
答:0.20 molL﹣1s﹣1 ;
③依据上述三行计算得到平衡时NO的转化率为 ![]() ×100%=90%,
×100%=90%,
答:达到平衡时NO的转化率为90%.
【解析】解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
②2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1根据盖斯定律,②﹣①可得:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=﹣752.1 kJmol﹣1 , 所以答案是:2H2(g)+2NO(g)=N2(g)+2H2O(l)△H=﹣752.1 kJmol﹣1;(2)①温度T2到达平衡的时间短,反应速率快,故温度T2>T1 , 温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,所以答案是:<;②催化剂的表面积S1>S2 , 则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为  ,所以答案是:
,所以答案是:  ;
;
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在碘水中加入适量CCl4振荡,静置后可观察到的现象为
A. 不分层,溶液呈紫色 B. 不分层, 溶液呈棕色
C. 分层,上层为紫色 D. 分层,下层为紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋壳的主要成分是CaCO3,含有少量的SiO2、MgCO3及色素等杂质,测定蛋壳中钙含量的操作步骤如图所示:
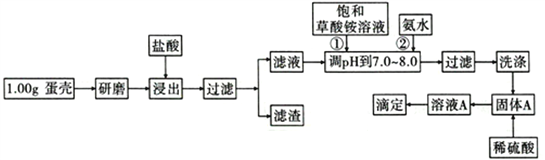
已知:CaC2O4、MgC2O4都难溶于水。
回答下列问题:
(1)样品溶于盐酸后得到的滤渣主要是________________________________。
(2)①②操作时,加入饱和(NH4)2C2O4溶液和氨水的作用是_______________________。
(3)洗涤最好选用_____(填“冰水”或“0. lmol/L草酸铵溶液”),其目的是____________________。
(4)在一定温度下,向2L的密闭容器中放入足量的草酸钙(固体所占体积忽略不计)发生反应: CaC204(s) ![]() CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
CaO(s)+CO(g)+CO2(g),若前5min 内生成 CaO 的质量为11.2g,则该段时间内v(CO)=_______。
(5)滴定操作是用标准酸性高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,可间接求出钙的含量。 步骤1:将溶液A加蒸馏水稀释至250mL。
步骤2:取稀释后的溶液25.00mL于锥形瓶中,加稀H2SO4酸化。
步骤3:用0.0190 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消粍KMnO4溶液V1mL。
步骤4:重复步骤2、步骤3的操作3次,记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol /L) | KMnO4液滴入的体积(mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2= 20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4 = 20.80 |
①KMnO4溶液和草酸溶液在稀硫酸中反应的离子方程式为____________________。
②滴定终点的现象是________________________________________。
③该蛋壳中CaCO3的质量分数=_______%,则此法求得的钙含量_________实际值(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3和K2CO3为电解质、以CH4为燃料,该电池的工作原理如下图所示,下列说法正确的是
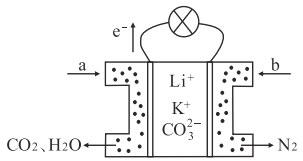
A. 电极a为负极,发生氧化反应 B. CO32-向正极移动
C. 正极电极反应式为O2+2H2O+4e-=4OH- D. 此电池在常温下也能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b B. 混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
C. 混合溶液的pH=7 D. 混合溶液中,c(H+)=![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据不同原料,该药物合成路线通常有两条,其中以2-氯苯甲醛为原料的合成路线如下图所示:
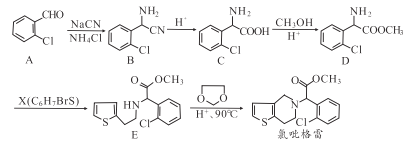
(1)分子A中非含氧官能团的名称为__________。
(2)X的结构简式为__________。
(3)分子C可在一定条件下反应生成一种含有3个六元环的产物,写出该反应的化学方程式__________。
(4)D-E的反应类型是__________。
(5)A的所有同分异构体(不包括A)中,同于芳香族化合物的有__种。
(6)已知: ![]() ,则由甲醇和乙醇为原料制备化合物
,则由甲醇和乙醇为原料制备化合物![]() 涉及的反应类型有_________ (填编号),写出制备化合物
涉及的反应类型有_________ (填编号),写出制备化合物![]() 最后一步反应的化学方程式_________。
最后一步反应的化学方程式_________。
①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于各实验操作,下列说法错误的是
A. 蒸馏前应往蒸馏烧瓶中加入少量沸石
B. 取用金属钠时,多余的钠应放回煤油中
C. 容量瓶用蒸馏水洗净后必须烘干才能使用
D. 可用焰色反应鉴别NaCl和KCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,可能大量共存的是( )
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 水电离出的c(H+)=10-13mol·L-1的溶液中:Fe3+、K+、CO32-、SO32-
C. 室温下, Kw/c(H+)=0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
D. 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
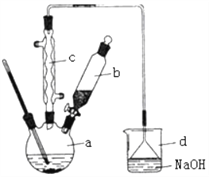
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生的化学方程式为_______________________;继续滴加至液溴滴完。仪器a的名称是___________装置d中的作用是_______________________。仪器c为冷凝管,其进水口为__________________(填“上”或“下”)口。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______________________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为____,要进一步提纯,下列操作中必须的是____。
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com