
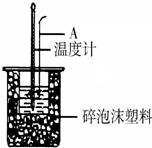
 利用如图装置测定中和热的实验步骤如下
利用如图装置测定中和热的实验步骤如下分析 (1)仪器A的名称环形玻璃搅拌棒;
(2)为了确保定量的硫酸反应完全,所用NaOH稍过量;
(3)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(4)a.装置保温、隔热效果差,测得的热量偏小;
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好,热量散失较多;
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,H2SO4的起始温度偏高;
(5)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化,影响测定结果;
(6)浓硫酸稀释放热,放出热量;
(7)CH3COOH(aq)与NaOH(aq)反应可分为两步:①CH3COOH在水溶液中电离CH3COOH?H++CH3COO-;②产生的H+与NaOH(aq)反应,利用盖斯定律进行计算,可得CH3COOH在水溶液中电离的反应热.
解答 解:(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)实验中,所用NaOH稍过量的原因是确保定量的硫酸反应完全,
故答案为:确保硫酸被完全中和;
(3)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:B;
(4)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好,热量散失较多,测得温度偏低,中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入盐酸测温度,盐酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确;
故答案为:abc;
(5)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应也会有热效应,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热.
故答案为:不能;H2SO4与Ba(OH)2反应除生成水外,还会发生Ba2+,SO42-的反应,该反应也会有热效应;
(6)由于浓硫酸稀释放热,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ;
故答案为:大于;浓硫酸溶于水放出热量;
(7)CH3COOH(aq)+OH-(aq)═CH3COO-(aq)+H2O(l)△H=-12.1kJ•mol-1 ①
H+(aq)+OH-(aq)═H2O(l)△H=△H=-55.6kJ•mol-1 ②
用①-②可得CH3COOH电离的热化学方程式为:CH3COOH(aq)?H+(aq)+CH3COO-(aq)△H=-12.1kJ•mol-1-(-55.6kJ•mol-1)=+43.5kJ•mol-1;
故选C.
点评 本题主要考查中和热的测定、盖斯定律的运用,题目难度大,注意理解中和热的概念、反应热的误差分析等问题.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:推断题
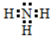 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com